(1)将等质量的Zn粉分别投入:a:10 mL 0.1 mol·L-1 HCl和b:10 mL 0.1 mol·L-1醋酸中。
①若Zn不足量,则反应速率a_ _____b。(填“>”、“=”或“<”,下同)
②若Zn过量,产生H2的量a__ ____b。
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸和b:醋酸中。
①若Zn不足量,则起始反应速率a__ ____b。
②若Zn过量,产生H2的量a_ _____b。
(1)在研究的化合物分子中,所处环境完全相同的氢原子在质子核磁共振谱(PMR)中出现同一种信号峰,如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。化学式为C2H6O的物质在PMR谱上观察到下列两种情况下:化合物A出现一个信号峰,化合物B出现三个信号峰,由此可推断有机物质结构式为:A 、B 。
(2)①生活中PVC管材的成分为聚氯乙烯。氯乙烯可以由乙炔和氯化氢反应制得,其化学方程式为;
②聚乙炔是制备有机导体材料的重要原料,请写出制得聚乙炔的化学方程式。
(3)C7H8是苯的同系物,
①它的一氯代物有种;
②它被酸性高锰酸钾溶液氧化后,有机产物的结构简式为;
③它可以与足量的浓硫酸和浓硝酸的混酸反应制备烈性炸药TNT,反应方程式为。
根据下面的反应路线及所给信息填空: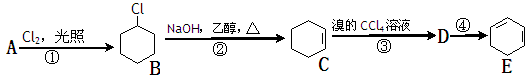
(1)A的结构简式是,名称是;
(2)填写以下反应的反应类型:①;②;③;
(3)反应④的反应试剂及反应条件;
(4)反应②的化学方程式为;
B水解的化学方程式为。
14分)0.3 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A跟HCl反应后,生成产物中的H原子的结构环境完全相同,写出该反应的化学方程式____。
(4)若一分子烃A被酸性高锰酸钾溶液氧化后,能够生成两分子B,则结构简式分别为:
A、B。
(5)若烃A与Br2的CCl4溶液反应后的产物为1,2-二溴丁烷,请写出由烃A发生加聚反应的化学方程式。
下面A~F是几种常见烃的分子球棍模型。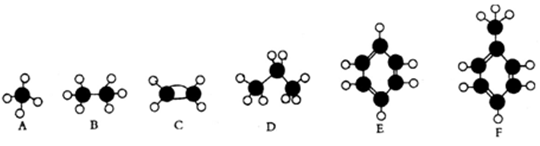
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是。
(2)能够发生加成反应的气态烃是。
(3)一氯代物的同分异构体最多的是。
(4)所有原子均在同一平面上的是。
(5)能使酸性高锰酸钾溶液褪色的是(填对应字母)。
出下列反应化学方程式,并写出该反应属于何反应类型。
(1)乙烯使溴水退色; 。
(2)苯与浓硫酸和浓硝酸的混合液共热;。
(3)由乙炔制聚氯乙烯;。
(4)乙烷与Cl2在光照条件下1:1反应:;___________。
(5)3—甲基—1—丁炔与溴的四氯化碳溶液按物质的量为1:1反应:;_____________。
(6)用甲苯制2,4,6-三溴甲苯:;__________。