下面A~F是几种常见烃的分子球棍模型。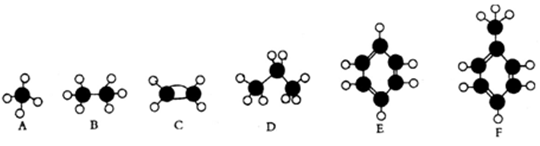
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 。
(2)能够发生加成反应的气态烃是 。
(3)一氯代物的同分异构体最多的是 。
(4)所有原子均在同一平面上的是 。
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母)。
将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),试回答下列问题:
(1)反应放出的气体中,含有和(写化学式)。
(2)完全反应后,所得溶液中的溶质是。
(3)写出反应过程其中1个化学反应的化学方程式:。
(4)整个反应过程中,被还原的HNO3总的物质的量是mol。
化学是一门以实验为基础的自然科学。
(1)下列说法中,符合实验安全规范要求的是(填序号字母)。
① 闻气体的气味时,应用手在瓶口轻轻煽动,使少量的气体飘进鼻孔
② 在实验室做铜和浓硝酸反应制备二氧化氮的实验时,应该在通风橱中进行
③做H2还原CuO实验时,先加热CuO至高温,然后立即通入H2使反应发生
④实验中当有少量的过氧化钠剩余时,用纸包裹好后将其放入垃圾桶中
(2)某学习小组用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应及部分产物的性质(装置中的铜丝可适当上下抽动)。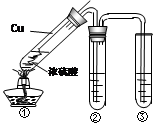
① 当反应进行一段时间后,欲使反应迅速停止,可采取的措施为。
② 若装置②用来检验生成的气体产物的性质,在装置②的试管中加入的试剂为品红试液,通入气体后,现象为,此现象证明该气体产物具有性。
③ 装置③中盛有某单质的水溶液,用来检验气体产物的还原性,则该单质的水溶液为
,反应的化学方程式为。
④ 实验最后,要将图①大试管中的液体与水混合,以观察颜色检验存在的离子,从安全角度考虑,混合的方法应该是。
⑤ 实验中,在所用仪器及仪器间连接都完好的情况下,同学们仍闻到了较强的刺激性气味,说明此实验的整套装置设计有缺陷,会造成空气污染。改进此实验装置的方法是。
下列是中学常见的一些物质之间的转化关系(其中部分反应产物省略),其中I是一种金属单质,A是一种黄绿色的非金属单质;F、M、N均为难溶于水的白色沉淀物质,M和N不溶于稀硝酸;B是一种具有刺激性气味的气体,且具有漂白性;C和D是中学化学中两种常见的强酸。请回答下列问题: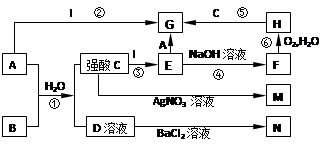
(1)写出物质B和M的化学式:B., M.;
(2)写出E→G转化反应的离子方程式:;
(3)写出反应⑥的化学方程式:;
(4)写出反应⑤的离子方程式: 。
氧化还原反应是重要的一类化学反应。
(1)在化学反应2KMnO4 + 10KI + 8H2SO4=6K2SO4+ 2MnSO4 + 5I2 + 8H2O中,化合价降低的元素是 ,发生氧化反应的物质是。
(2)据反应8NH3 + 3Cl2=6NH4Cl + N2回答下列问题:
①该反应中,氧化剂是 ,还原剂是。
②该反应中,当有8mol NH3反应时,转移电子总量是mol。
③参加反应的氧化剂与还原剂的物质的量之比为 (最简整数比)。
④当有3mol e- 转移时,该反应生成的氧化产物的质量是g。
铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:
(1)下列各物质中,不能和单质铝反应的物质是(填下列各项序号)。
①Fe②FeCl3③FeSO4
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,实验得到的分散系
属于(填“溶液”“浊液”或“胶体”),所得到的分散系中的分散质具有的性质有如下的(填写序号)。
①电泳②透过半透膜③聚沉④具有强还原性
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:;证明反应后的溶液中存在Fe3+的实验方法是。