(1)用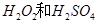 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: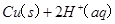 ====
====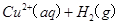 △H=64kJ/mol ①
△H=64kJ/mol ①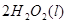 ====
====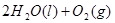 △H= -196kJ/mol ②
△H= -196kJ/mol ②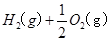 ="==="
="===" 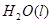 △H= -286kJ/mol ③
△H= -286kJ/mol ③
在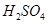 溶液中
溶液中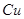 与
与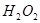 反应生成
反应生成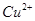 和
和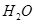 的热化学方程式
的热化学方程式
为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅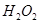 和3.0 mol/L的
和3.0 mol/L的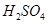 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| |
温 度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| |
铜平均溶解速率 |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
| |
( ) ) |
|
|
|
|
|
|
|
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因
是 。
(3)在提纯后的 溶液中加入一定量的
溶液中加入一定量的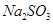 和
和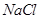 溶液,加热,生成
溶液,加热,生成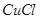 沉淀。制备
沉淀。制备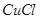 的离子方程式是 。
的离子方程式是 。
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型是 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1mol CO2中含有的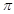 键数目为 。
键数目为 。
(3)向CuSO4溶液中加入过量的NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
已知W、X、Y、Z为四种短周期元素,原子序数逐渐增大。其中W形成的单质是自然界中最轻的气体;X原子的最外层电子数是次外层电子数的2倍;Y元素是地壳中含量最多的元素;Z元素是短周期中原子半径最大的元素。回答下列问题:
(1)X6W6的结构简式为,分子空间构型为。
(2)Y与Z形成的两种常见化合物的电子式分别为和
(3)由W、X、Y三种元素形成的最简式为XW2Y的化合物有A和B两种,其中A的相对分子质量是60,是日常生活中的一种调味品的主要成分,则A的结构简式为;B的相对分子质量是A的3倍,在正常人的血液里含有0.1%的B,则B的分子式。将B物质的溶液与新制的Cu(OH)2悬浊液共热,观察到得现象是。
(4)将B在酒化酶的作用下可制得另外一种具有特殊香味的液态有机物C,同时得到一种能导致温室效应的气体。写出该反应的化学方程式
(5)C是一种可以再生的清洁燃料,写出其燃烧的化学方程式
。C还可以在Cu或Ag的催化作用下被氧气氧化成具有刺激性气味的液体,该反应的化学方程式为。
立方烷是新合成的一种烃,其分子呈如图所示的立方体结构,立方体的每个顶点上都有一个碳原子和一个氢原子。
(1)立方烷的分子式是。
(2)其一氯代物共有种。
(3)其二氯代物共有种。
(4)其六氯代物共有种。
在一定条件下,用乙烷和乙烯制备氯乙烷(CH3CH2Cl),试回答:
(1)用乙烷制备氯乙烷的化学方程式是
反应类型是。
(2)用乙烯制备氯乙烷的化学方程式是
反应类型是。
(3)比较上述两种方法,第种方法好,其原因是
燃料电池是目前正在探索的一种新型电池。它的工作原理是在燃料燃烧过程中将化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是:X极:O2(g) + 4e- + 2H2O(l) ="==" 4OH-
Y极:H2(g)-2e- + 2OH- ="==" 2H2O(l)
(1)X极是电池的极(“正”或“负” ),发生反应(“氧化”或“还原” )反应。
(2)总的电池反应方程式
(3)若反应得到5.4g液态水,燃料电池中转移的电子为mol