有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、 Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如
Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如 下图所示:
下图所示:
请你根据上图推断:
(1)原溶液中一定存在的离子有(写化学式): 。
(2)写出实验④中沉淀量由A→B过程中所发生反应的离子方程式: 。
(3)实验③中产生无色无味气体所发生的化学方程式为: 。
有A、B、C、D、E五种短周期元素,其原子序数依次增大。A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1) C、D两元素形成的化合物的晶体类型是 。BC2的结构式
(2)若F是D的同主族下一周期元素,则F的电子排布式是:
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n。在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如右图所示,试填空。
①含1molA2C的该晶体中有_____mol“氢键”。
②若G是C的同主族下一周期元素,请比较A2C与A2G沸点的高低______________。
根据要求填空:
(1)写出下列有机物的键线式: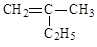 ___________ CH3CH2CH2COOH _________
___________ CH3CH2CH2COOH _________
(2)写出有机物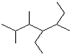 的结构简式
的结构简式
(3)[Ni(NH3)2Cl2]可以形成A、B两种固体,A在水中溶解度较大;B在CCl4中溶解度较大。试画出A、B分子的几何构型。
(5分)X、Y、Z是ⅠA--ⅦA族的三种非金属元素,它们在周期表中的位置如右图所示。试完成下列问题: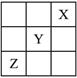
(1)X元素单质的化学式是__________。
(2)Y元素的原子结构示意图是__________,Y与Na所形成化合物的电子式为__________。
(3)Z元素的名称是__________,其价电子排布式为__________。
(12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。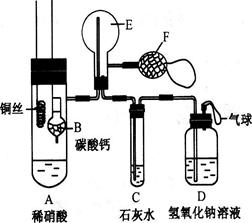
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作。
如何确定E中空气已被赶尽:__________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________
已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E(分子式为C4H8O2),其合成路线如下图所示。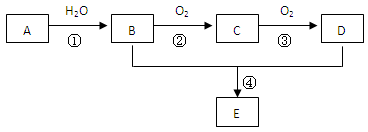
请回答下列问题:
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的化学方程式:
①;反应类型:。
④;反应类型:。