根据提供条件推断元素,并按要求填空:原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式 ________ ,最高价氧化物对应水化物化学式 ________ ,其最高价氧化物对应水化物与NaOH反应的化学方程式为 ___________________________。
第3周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为______________,最高价氧化物对应水化物与氢氧化钠反应的化学方程式为 _______________。
原子序数依次递增的同周期四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 _______ 、 ________ 、 ________ 、 ________ 。
某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素最高价氧化物的化学式为 ________ 。
将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。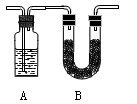
(1)A管应装入的物质,B管应装入的物质;
(2)此有机物的分子式;
(3)该有机物1分子中有1个苯环,试写出它的所有同分异构体的结构简式。
完成下列小题
I、某有机化合物结构简式如图所示: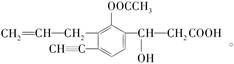
(1)写出其分子式________。
(2)写出所有含氧官能团的名称____________________。
(3)该有机化合物的性质与醋酸相似,写出该化合物与NaHCO3反应的方程式:
II、写出下列有机物的系统命名或结构简式:
(1) ____________。
____________。
(2)CH3CH(CH3)C(CH3)2(CH2)2CH3____________。
(3)间甲基苯乙炔____________。
(4)2-甲基-1,3-丁二烯____________。
下表为元素周期表的一部分用元素符号或化学式回答下列问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
① |
⑦ |
④ |
||||
| 3 |
③ |
⑤ |
⑧ |
⑩ |
||||
| 4 |
② |
⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________,该分子含有________(填“极性”或“非极性”)键。26号Fe元素在元素周期表中的位置是。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为。第三周期中除⑩元素以外离子半径最小的是(填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是(填化学式),元素⑦的氢化物的结构式为;该氢化物和元素④单质反应的化学方程式为。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为。
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式。
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式;该化合物与二氧化碳的方程式为;④⑧⑨元素的离子的还原性由强到弱顺序为(用离子符号答题)。
4g D2和20g18O2化合时最多能生成g D218O,1mol D218O中含mol质子,含mol中子。
有下列物质:①CaCl2 ②PH3 ③H2O2 ④Na2O2 ⑤KOH ⑥(NH4)2SO4 ⑦F2(答题填编号)
(1)含有离子键的物质,含有非极性键的离子化合物;
(2)含有极性键的物质;
(3)含有非极性键的共价化合物;