氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。
(2)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g) △H=" -574" kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g) △H=" -1160" kJ·mol-1 根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时△H= 。
(3)同温同压下,3.5 L NH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示,则n3 = p=  。
。
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中只有C为金属元素,A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A,B,C,D。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,非极性分子有;其结构中存在非极性键的分子晶体有;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种:、。
把淀粉溶液溶于沸水中,制成淀粉胶体。
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是,该操作的名称是。
(8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(不需配平)_________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:
________________________________________________________________________。
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl•xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、 Al2O3、HCl和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。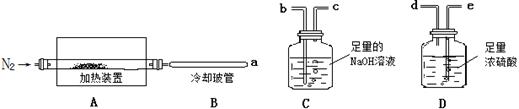
(1)Mg2Al(OH)6Cl•xH2O热分解的化学方程式为。
(2)若只通过测定装置C、D的增重来确定 ,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
(3)加热前先通过N2排尽装置中的空气,反应完成后,再持续通入N2的作用是。
(4)完全分解后测得C增重3.65g、D增重9.90g,则 =.
=.
(10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为
Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为
(5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为