已知离子反应:RO3n-+6I - +6H +  R - +3I 2 +3H 2 O,试根据离子方程式必须“质量守恒、电荷守恒”等判断:n=__________,R元素在 RO3n-中的化合价是__________。
R - +3I 2 +3H 2 O,试根据离子方程式必须“质量守恒、电荷守恒”等判断:n=__________,R元素在 RO3n-中的化合价是__________。
甲醇是一种用途广泛的化工原料。
(1)工业上常用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1= -90.1KJ/mol
CH3OH(g) ΔH1= -90.1KJ/mol
②CO2(g)+ 3H2(g)  CH3OH(g) + H2O(l)ΔH2
CH3OH(g) + H2O(l)ΔH2
已知:CO(g)+ H2O (g) = CO2 (g) + H2 (g)ΔH3=-41.1 KJ/mol③
H2O (l) =H2O (g)ΔH4=+44.0KJ/mol④
则ΔH2=
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min |
4min |
6min |
8min |
… |
|
| CO |
0.07 |
0.06 |
0.06 |
0.05 |
… |
| H2 |
x |
0.12 |
0.12 |
0.2 |
… |
| CH3OH |
0.03 |
0.04 |
0.04 |
0.05 |
… |
①x=。
②250℃时该反应的平衡常数K值为:(不必化简)。
③若6min~8min只改变了某一条件,所改变的条件是。
④第8min时,该反应是不是达到平衡状态。(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.。
(3)电解甲醇水溶液制氢的优点是需要的电压低,而且制得的氢气比电解相同物质的量的水多。写出电解甲醇水溶液的反应式为:阳极:。
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为:
已知:①NaFeO2遇水强烈水解;
②重铬酸钾为橙红色针状晶体,溶于水,不溶于乙醇,有强氧化性;
③2CrO42- + 2H+ Cr2O72-+ H2O
Cr2O72-+ H2O
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
(2)①铬铁矿经粉碎处理的目的是。
②写出Cr2O3和纯碱、氧气反应生成Na2CrO4的化学方程式为;
③NaFeO2水浸时强烈水解生成氢氧化铁沉淀,离子方程式为______。
(3)滤液1的成分除Na2CrO4、NaOH外,还含有(填化学式),
(4)通过途径Ⅰ从Na2CrO4溶液获得K2Cr2O7晶体,操作步骤有:“酸化”→加KCl固体→蒸发浓缩→操作a→过滤→洗涤→干燥。
① “酸化”步骤用醋酸调节溶液pH<5,其目的是;
②操作a的名称。
氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率(注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=______(用分数表示)(mol/L)-2。
中学化学常见有机物A(C6H6O)能合成紫外线吸收剂BAD和某药物中间体F,合成路线为: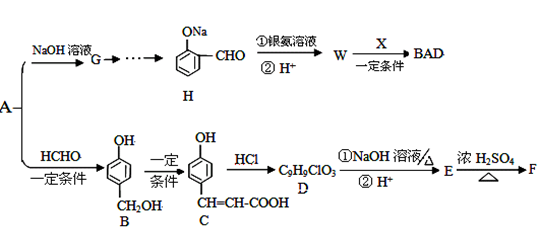
已知:BAD的结构简式为: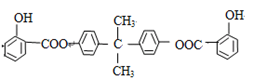
F的结构简式为: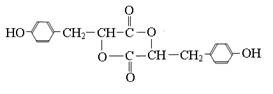
C中含氧官能团的名称,W的结构简式。
(2)反应类型 A→B 。
(3)1mol C充分反应可以消耗mol Br2 ;C和过量 NaOH溶液反应的化学方程式。
(4)C→D的过程中可能有另一种产物D1,D1的结构简式。
(5)E的结构简式为。反应类型 E→F。
(6)W的同分异构体有多种,写出一种符合以下要求的W的同分异构体的结构简式:
① 遇FeCl3溶液呈紫色; ② 能发生银镜反应;③ 苯环上的一氯代物只有两种。。
碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下: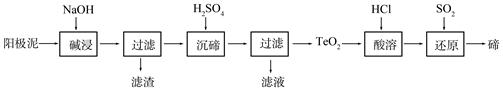
①“碱浸”时TeO2发生反应的化学方程式为。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀不完全,原因是;防止局部酸度过大的操作方法是。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是。