氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还原滴定的反应体系中有反应物和生成物共六种,MnSO4、KMnO4、K2SO4、H2SO3、H2SO4、H2O,其中H2SO3的还原性最强,KMnO4 的氧化性最强。对此反应体系:
(1)被氧化的元素是_______;发生还原反应的过程是________→______。
(2)请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3)反应中H2 SO4 是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4)当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5)用标准KMnO4 溶液滴定H 2 SO3 时,滴定终点时颜色变化是_______。
(6)滴定过程中.下列图像所表示的关系正确的是_______(填编号)。 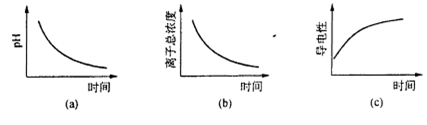
A、B、C三种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈中性,B的水溶液呈碱性,C的水溶液呈酸性,请找出B、C可能的两种组合,要求B1溶液中水的电离程度小于B2溶液中水的电离程度,C1溶液中水的电离程度小于C2溶液中水的电离程度。(已知0.1mol/LHNO2溶液pH>1)
(1)写出化学式: A____________ B1____________ B2____________
(2)25℃时,B1溶液中水电离出的OH—的物质的量浓度_______10—7mol/L
(填>、<、=)
(3)25℃时,当B1、C1两稀溶液的物质的量浓度相等时,两溶液的pH值之和_____14(填>、<、=、≥、≤)。
(4)25℃时,pH=a(3<a<5)的C1、C2两溶液中水电离出的H+的物质的量浓度比值为。(用含a的代数式表示)
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
| 电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
| 电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:0.8< X <___________。
②写出K的基态原子的电子排布式:
K:_______________________________________
③根据表中的所给数据分析,同主族内的不同元素X的值变化的规律
是;简述元素电负性X的大小与元素金属性、非金属性之间的关系____________________。
在如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16g。试回答:
(1)电源中Y电极为直流电源的__________极。
(2)pH变化:A:________B:________ (填“增大”、“减小”或“不变”)。
(3) 若A中KCl溶液的体积是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
(4)B中电解CuSO4溶液的电极总反应:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO) /mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO) / mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是________ 反应(填写“吸热”、“放热”)。
(2)前2s内的平均反应速度v(N2)=________。
(3)此反应的平衡常数表达式为K=________。
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.Cr2O72—和CrO42—的浓度相同
b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Cr3+ (aq)+3OH—(aq) 常温下,Cr(OH)3的溶度积
Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。