已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO(g)+H2(g);②C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2 (g);ΔH=-393.5 kJ·mol-1
CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)=H2O(g);ΔH=-242.0 kJ·mol-1
请回答:
(1)根据以上信息,写出CO与水蒸气反应的热化学方程式:____________________________。
(2)如图是根据盖斯定律做出的循环图,根据图的转化关系和热化学方程式计算ΔH3=________kJ/mol。
请比较ΔH1与ΔH3数值是否可以说明用水煤气做燃料要比直接燃煤放出的热量多________(是或否)原因是___________________________________。
(3)目前煤的运输还主要靠铁路运输和公路运输,你能在所学知识基础上提出缓解铁路和公路运输的方法:____________________________。
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为:;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
①加氧化剂X的目的是,下列氧化剂中最适合作氧化剂X的是(填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
②物质Y的化学式是;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是;若25℃时,a=3的溶液中,c(Fe3+)=mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 电离平衡常数 |
Ka=1.8×10-5 |
Kal=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是。
A.c(H+)B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+;
②c(H+)+c(Na+)=。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为,C的元素符号为;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其E+ 的电子排布式为。
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是; 1 mol O22+中含有的π键数目为。氧元素与氮元素能形成多种分子,试写出与N2O分子互为等电子体的一种阴离子。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为。
铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
方法一、还原法:
(Ⅰ)在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下: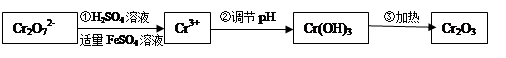
请回答下列问题:
(1)上述流程①发生反应的离子方程式是。
(2)若在① 使FeSO4适当过量、空气适量,可产生具有磁性、组成类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物(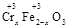 ·y
·y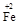 O)(注:X可以是分数),变废为宝。则控制空气适量的目的是,使铁氧体分离出来较简便的方法是。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是,使铁氧体分离出来较简便的方法是。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物( ·y
·y O)化学式是。
O)化学式是。
(Ⅱ)研究发现,用铁粉作还原剂不仅可以除去Cr6+,还能除去废水中的少量Mn2+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,
(3)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为时锰、铬去除率最好
(4)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH=时锰、铬去除率最好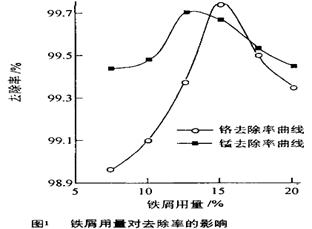

方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)写出此阴极反应的电极方程式。
(6)现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。