利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g);△H=mkJ·mol-1
2SO3(g);△H=mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。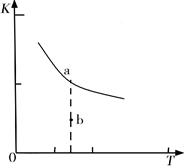
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到 (NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2O NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,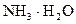 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
化学家利用钯(Pd)作催化剂,将有机化合物进行“裁剪”“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为:
(R—X中的R通常是不饱和烃基或苯环;R′CH=CH2通常是丙烯酸酯或丙烯腈CH2=CH—CN等):
现有A、B、C、D等有机化合物有如下转化关系(部分反应条件省略)
请回答下列问题:
(1)反应Ⅰ的化学方程式为__________________________________________________。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加氢的化学方程式:________________________________________。写出上述催化加氢后的产物的同分异构体的结构简式________________________________________。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为______________________________。
(4)写出B转化为C的化学方程式:______________________________反应类型为__________。
(5)D的结构简式为(必须表示出分子的空间构型)______________________________。
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为______________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________________。
(3)写出由C生成D的化学方程式______________________________反应类型是__________,由G生成A的化学方程式______________________________反应类型是__________。由G生成F的化学方程式______________________________反应类型是__________。G发生催化氧化的化学方程式______________________________。
(4)F的核磁共振氢谱图有__________个吸收峰,峰面积之比为__________。
(1)一定条件下某烃与H2按物质的量之比1:2加成生成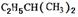 ,则该烃的结构简式为______________________________;
,则该烃的结构简式为______________________________;
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。
若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为____________________。
(3)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式
(4)下列括号内为杂质,将除去下列各组混合物中杂质所需的试剂和方法填写在横线上。
① 溴乙烷(乙醇)____________________________________________________________
② 苯酚(苯)______________________________________________________________________
写出②操作中涉及到的反应的化学方程式________________________________________
(5)已知: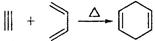 ,如果要合成
,如果要合成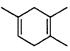 所用的原始原料可以是()
所用的原始原料可以是()
A.2-甲基-l,3-丁二烯和2-丁炔 B.2,3-二甲基-1,3-戊二烯和乙炔
C.2,3-二甲基-l,3-丁二烯和丙炔 D.1,3-戊二烯和2-丁炔
将下列有机物进行系统命名
①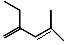 ____________________②
____________________②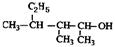 ____________________
____________________
A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。