某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

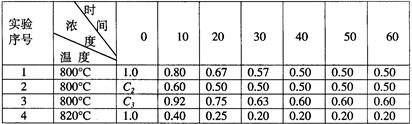
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20 min时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c(2)= mol/L,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<=, 且c3=____________mol·L-1。
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
。
2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排”和“低碳经济”的绿色环保主题,中国宣布了2020年二氧化碳排放量下降40~45%的减排目标。下列不符合这一主题的是()
| A.自备购物布袋,不用塑料方便袋 |
| B.开发新能源,如太阳能、风能等,减少对化石能源的依赖 |
| C.推广煤的气化、液化技术,提供清洁燃料和化工原料 |
| D.给汽车安装尾气处理器 |
鸦片具有复杂的组成,其中的罂粟碱的分子结构如图。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为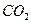 、
、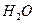 和
和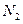 ,1 mol该化合物完全燃烧消耗
,1 mol该化合物完全燃烧消耗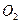 的物质的量及在一定条件下与
的物质的量及在一定条件下与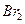 发生苯环取代反应生成的一溴代物同分异构体的种数分别是()
发生苯环取代反应生成的一溴代物同分异构体的种数分别是()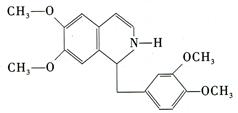
| A.23.75 mol;5 | B.24.5 mol;7 |
| C.24.5 mol;8 | D.26.5 mol;6 |
将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中加入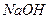 溶液,生成沉淀的物质的量与加入
溶液,生成沉淀的物质的量与加入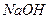 溶液的体积关系如下图所示。若不考虑金属和盐酸反应时
溶液的体积关系如下图所示。若不考虑金属和盐酸反应时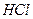 的发挥,则下列说法正确的是()
的发挥,则下列说法正确的是()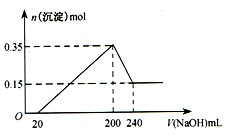
| A.镁和铝的总质量为9 g |
| B.盐酸的物质的量浓度为5mol·L-1 |
C.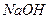 溶液的物质的量浓度为0.5mol·L-1 溶液的物质的量浓度为0.5mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2L |
据报道,最近摩托罗拉公司研发出一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为: ,则下列说法错误的是()
,则下列说法错误的是()
A.放电时 参与反应的电极为正极 参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
C.放电时负极的电极反应为: |
D.充电时每生成1 mol 转移6 mol电子 转移6 mol电子 |
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是()
A. 的水解产物是 的水解产物是 和 和 |
B. 的水解产物是 的水解产物是 和 和 |
C. 的水解产物之一是 的水解产物之一是 |
D. 的水解产物是两种碱性物质 的水解产物是两种碱性物质 |