将6 mol A和5 mol B两气体通入容积为4 L的密闭容器,一定条件下反应3A(g)+B(g) 2C(g)+xD(g);ΔH<0,经5 min达平衡,此时生成2 mol C,测得D的平均反应速率为0.1 mol·(L·min)-1,下列说法正确的是
2C(g)+xD(g);ΔH<0,经5 min达平衡,此时生成2 mol C,测得D的平均反应速率为0.1 mol·(L·min)-1,下列说法正确的是
| A.若降低该平衡体系的温度,则逆反应速率减小,正反应速率增大,平衡正向移动 |
| B.恒温下,当容器中C和D的生成速率达到相等时,该反应达到平衡状态 |
| C.A的平均反应速率为0.15 mol·(L·min)-1 |
| D.达平衡时B的转化率为25% |
木糖醇是一种新型的甜味剂,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者的需要。它是一种白色粉末状的结晶,结构简式为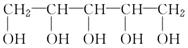 ,下列有关木糖醇的叙述中不正确的是
,下列有关木糖醇的叙述中不正确的是
| A.木糖醇是一种单糖,与葡萄糖互为同系物 |
| B.1 mol木糖醇与足量钠反应最多可产生2.5 mol H2 |
| C.木糖醇易溶于水,能发生酯化反应 |
| D.糖尿病患者可以食用 |
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是
| A.反应①是加成反应 | B.只有反应②是加聚反应 |
| C.只有反应⑦是取代反应 | D.反应④⑤⑥是取代反应 |
有关溴乙烷的下列叙述中,正确的是
| A.在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 |
| B.溴乙烷不溶于水,能溶于大多数有机溶剂 |
| C.溴乙烷与NaOH的醇溶液反应,可生成乙醇 |
| D.溴乙烷通常用溴与乙烷直接反应来制取 |
丁香油酚的结构简式为: 下列关于该有机物的说法中,正确的是
下列关于该有机物的说法中,正确的是
| A.丁香油酚的分子式为C10H10O2 |
| B.丁香油酚易溶于水 |
| C.丁香油酚能发生加成反应、加聚反应、取代反应 |
| D.丁香油酚与苯酚互为同系物,可以和碳酸钠反应生成CO2 |
有七种物质: ①甲烷; ②苯; ③乙烯; ④聚乙烯; ⑤2—丁炔; ⑥环己烷; ⑦邻二甲苯;
既能使酸性KMnO4溶液褪色又能与溴水反应使之褪色的是
| A.③⑤ | B.③④⑤ | C.②③⑤ | D.③④⑤⑦ |