牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡,向右为脱矿过程,向左为矿化过程:Ca5(PO4)3OH(s) 5Ca2++3
5Ca2++3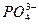 +OH-
+OH-
(1)人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是____
_______________________________________________________________________________。
(2)Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能够防止龋齿的原因是___________________________________。
(3)根据以上原理,请提出一种其他促进矿化的方法________________________________。
从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(一)海水淡化的方法主要有 (只填一种)。
(二)从海水中提取溴和镁的流程如下图所示: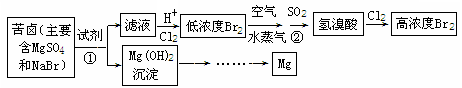
(1)提取Br2时,第一次通入Cl2后发生反应的离子方程式是
②中SO2表现 (填“氧化”或“还原”)性;第二次通入Cl2后,要提取Br2还要进行的操作为 。
(2)为了实现对镁离子的富集,①中加入的足量试剂是 (填化学式);
请从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是 (填字母)。
A.Mg(OH)2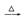 MgO MgO  Mg Mg |
B.Mg(OH)2 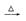 MgO MgO  Mg Mg |
C.Mg(OH)2 无水MgCl2 无水MgCl2 Mg Mg |
D.Mg(OH)2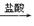 MgCl2(溶液) MgCl2(溶液) Mg Mg |
将检验下列溶液所用试剂的序号填入相应的括号中。
①检验葡萄糖溶液();
②检验淀粉溶液();
③检验蛋白质溶液()。
| A.KI溶液 |
| B.碘水 |
| C.浓硝酸 |
| D.稀硫酸 |
E.新制的Cu(OH) 2悬浊液
(12分) ①~⑩是元素周期表中的十种元素:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
① |
② |
③ |
||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
回答下列问题:
(1)某同学对下列性质进行了对比,其中正确的是 。
A.原子半径:⑩>⑨>⑦
B.离子半径:⑨>④>⑦
C.非金属性:③>②>⑥
D.单质的熔点:④>⑨>⑩>⑧
E.单质的氧化性:③>⑦>⑧
(2)用合适的化学用语回答:
金属性最强的元素离子结构示意图为 ,
常温下呈液态的氢化物的结构式为 。
溶于水后溶液显碱性的氢化物的电子式为 。
(3)在上述元素中,②、⑧元素形成的气态氢化物可以相互反应,该反应的化学方程式为 ;⑨、⑤元素形成的最高价氧化物的水化物可以相互反应,该反应的离子方程式为 。
(1)目前出现的“不粘锅”,其秘密就是表面有一种叫做“特氟龙”的涂层,实际上就是号称”塑料王”的聚四氟乙烯,试写出四氟乙烯单体合成“特氟龙”的化学方程式和其反应类型。
反应 类型
(2)请写出硬脂酸甘油酯制肥皂的化学方程式和反应类型
反应 类型
(3)请写出苯与浓硝酸反应的化学方程式和反应类型
反应 类型
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程_________________________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:_______________________________________________________。