表示反应N2(g)+3H2(g)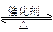 2NH3(g)(正反应为放热反应)在某一时间段内反应速率与反应过程的曲线关系图,则氨的体积分数最高的一段时间是( )
2NH3(g)(正反应为放热反应)在某一时间段内反应速率与反应过程的曲线关系图,则氨的体积分数最高的一段时间是( )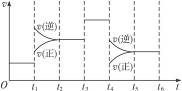
| A.t0—t1 | B.t2—t3 | C.t3—t4 | D.t5—t6 |
化学平衡状态I、II、III的相关数据如下表:
| 编号 |
化学方程式 |
平衡常数 |
温度 |
|
| 979K |
1173K |
|||
| I |
Fe(s)+CO2(g)  FeO(s)+CO(g) FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
| Ⅱ |
CO(g)+H2O(g)  CO2(g)+H2(g) CO2(g)+H2(g) |
K2 |
1.62 |
b |
| Ⅲ |
Fe(s)+H2O(g)  FeO(s)+H2(g) FeO(s)+H2(g) |
K3 |
a |
1.68 |
根据以上信息判断,下列结论错误的是
A.a>bB.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动 D.反应II、III均为放热反应
下列与化学反应能量变化相关的叙述正确的是( )
| A.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ |
| B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1 |
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,若用铜质材料搅拌棒代替环形玻璃搅拌棒,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
下列事实不能用勒沙特列原理解释的是( )
| A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| B.增大压强,有利于SO2和O2反应生成SO3 |
| C.用排饱和食盐水法收集Cl2 |
D.工业制取金属钾Na(l)+ KCl(l) NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来 NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来 |
在密闭容器中发生如下反应:mA(g) + nB(g)  pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
| A.m+n>p | B.平衡向逆反应方向移动 |
| C.A的转化率降低 | D.C的体积分数减小 |