在一个容积为6 L的密闭容器中,放入3 L X(g)和2 L Y(g),在一定条件下发生反应:
4X(g)+nY(g) 2Q(g)+6R(g)
2Q(g)+6R(g)
反应达到平衡后,容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小1/3,则该反应中的n值为( )
| A.3 | B.4 | C.5 | D.6 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1mol CO和1 mol H2O,在II中充入1 mol CO2和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法不正确的是
CO2(g)+H2(g)ΔH<0。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1mol CO和1 mol H2O,在II中充入1 mol CO2和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法不正确的是
| A.容器I、II中正反应速率不相同 |
| B.容器I中CO 的物质的量比容器II中的多 |
| C.容器I中反应的平衡常数小于III中 |
| D.容器III中CO 的浓度比容器II中CO浓度的2倍还多 |
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. <1.0×10-7mol/L <1.0×10-7mol/L |
| B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(H+)+c(NH4+)>c(OH-)+ c(HCO3-)+2 c(CO32-) |
| D.c(Cl-)> c(HCO3-) >c(NH4+) > c(CO32-) |
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是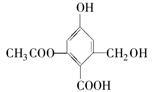
| A.X的化学式为C10H10O6 |
| B.X在一定条件下能与FeCl3溶液发生显色反应 |
| C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、5mol、1 mol |
| D.X既可以和乙醇又可以和乙酸发生酯化反应 |
下列分子式表示的有机物中,含单官能团的同分异构体数目最多的是
| A.C4H10O | B.C4H10 | C.C3H6O | D.C4H7Cl |