一定温度下,向密闭容器中加入等物质的量的SO2和O2,反应达平衡时,SO2的转化率是50%,此时SO3所占的体积分数为多少?
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650 mg·L-1,现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2====KOCN+2KCl+H2O
被氧化的元素是_________________。
(2)投入过量的液氯,可将氰酸盐进一步氧化为N2,请标出下列反应中电子转移的方向和数目:
2KOCN+4KOH+3Cl2====2CO2+N2+6KCl+2H2O
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯___________ g。
环保部门测定某气体样品中一氧化碳的含量,其方法和实验步骤如下:
(1)将2.000 L的气体样品通过盛有I2O5固体的加热管,发生的反应为:5CO+I2O5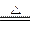 5CO2+I2。
5CO2+I2。
(2)将所产生的碘升华,并加入30.00 mL 0.005 0 mol·L-1的硫代硫酸钠溶液,发生的反应为:I2+2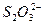 ====2I-+
====2I-+ 。
。
(3)将(2)中溶液取出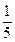 ,加入1.00 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.00 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1 L该气体样品中有多少毫克(mg)的CO。
有两瓶溶液,A溶液:1L 1mol·L-1的纯碱溶液;B溶液:1L 1.25mol·L-1的盐酸。试计算在下列两种情况下产生的CO2在标准状况下的体积各多少升?(忽略CO2溶解于水)
(1)将A逐滴加入到B中;
(2)将B逐滴加入到A中。
实验室有一种含有少量二氧化硅杂质的石灰石样品,某同学想准确测定该样品的纯度,他取用2.0 g样品于烧杯中,把20.0 mL稀盐酸分4次加入,充分作用后记录烧杯中固体质量如下表。请选择合适的数据并计算:
| 次序 |
稀盐酸/Ml |
剩余固体/g |
| 1 |
先加入5.0 mL |
1.32 |
| 2 |
再加入5.0 mL |
0.64 |
| 3 |
再加入5.0 mL |
0.20 |
| 4 |
再加入5.0 mL |
0.20 |
(1)该样品的纯度是多少?
(2)求所取用的稀盐酸的物质的量浓度?
(3)如果该同学选用稀硝酸测定样品纯度,你认为将对结果有何影响?
超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+3C 2AlN+3CO↑
2AlN+3CO↑
由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取20.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气6.72 L(标准状况)。
①上述反应的化学方程式为_____________________________________________________;
②该产品中AlN的质量分数为_______________________________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g·L-1(已折算成标准状况,AlN不跟O2反应)。该产品中含杂质碳__________g。(此问需写出计算过程)