在一密闭容器中充入1 mol NO2,建立如下平衡:2NO2 N2O4。平衡时测得NO2的转化率为a%。其他条件不变,再充入1 mol NO2,待新平衡建立时,测得NO2的转化率为b%。则a和b的大小关系为________________。
N2O4。平衡时测得NO2的转化率为a%。其他条件不变,再充入1 mol NO2,待新平衡建立时,测得NO2的转化率为b%。则a和b的大小关系为________________。
(本题共16分) 某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氮化铅,其中Pb为+2价)六种物质,已知Pb(N3)2是反应物之一,Cr2O3是产物之一。请回答下列问题:
(1)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 。
(2)1mol Pb(N3)2在反应中 (填“得到”或“失去”)mol
(3)NaNO2是一种食品添加剂,它能致癌。Cr(MnO4)2酸性溶液与NaNO2溶液能发生反应:
MnO4-+NO2-+ ═Mn2+ +NO3-+
请配平上述离子方程式,并标出电子转移的方向和数目。
(4)现欲配制100 mL 0.5mol/L的KMnO4溶液。回答下列问题:
①通过计算,应称取KMnO4固体的质量为g。
②配制时,溶液转移步骤中玻璃捧的正确使用方法是________________________.
(5)某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20.00mL未知浓度的NaNO2溶液置于锥形瓶中,取上述配好的KMnO4溶液装入酸式滴定管中,滴定完成后消耗KMnO4溶液10.00mL,则NaNO2溶液的物质的量浓度为 __________________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: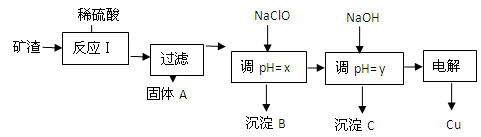
已知: Cu2O + 2H+=" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)反应I中如果Cu2O与 Fe2O3之间恰好完全反应,则发生反应的化学方程式为:__________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为: ____________________
(3)测定pH=y的仪器是___________________
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(5)电解初期阳极的电极反应式为________________________________
(本题共16分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: 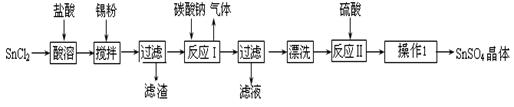
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)锡元素原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是。
(2)操作Ⅰ是。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 __________。
(4)加入Sn粉的作用有两个:①调节溶液pH② ______________________。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 _____________。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 mL。锡粉中锡的质量分数是。
(本题16分)某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1) 若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是:______________________
(2) 写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:
_________________________________________________________________________
(3) 经分析,该溶液所含的4种离子是:______________________________________
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变、②所含离子的物质的量均为1mol,则③是__________________________________________。
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为__________g。
(本题共16分)已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2的酸性溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出Bi在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为;
(3)实验④中的现象为:;
(4)实验②反应的离子方程式是:;
(5)实验③反应的离子方程式是:_。