在一个恒温恒容的密闭容器中,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),开始时充入容器中的起始物质是:①0.1 mol CO,0.1 mol H2 ②0.1 mol CO,0.2 mol H2O ③0.1 mol CO,0.1 mol H2O ④0.1 mol CO,0.1 mol H2O,0.1 mol H2。达到平衡时容器中H2的物质的量由小到大的排列顺序是____________。
亚硝酸钠易溶于水,有碱味,有氧化性,也有还原性。NaNO2大量用于染料工业和有机合成工业中,也可用作水泥施工的抗冻剂。然而由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
______NaNO2 + _______KI + _______ _______NO +______I2 +______K2SO4 +______Na2SO4+_______
_______NO +______I2 +______K2SO4 +______Na2SO4+_______
(1)请完成该化学方程式并配平。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了_______________个。
(3)现有25.00 mL的KI溶液,用酸化的10.00 mL 0.0500 mol/L的KIO3溶液处理(5I- + IO3- +6H+ = 3I2 + 3H2O)。将生成的I2全部除去后,再加入过量的KI溶液,使之与剩余的KIO3反应,然后将溶液调节至中性,析出的单质碘用0.1000 mol/L的Na2S2O3溶液滴定(2S2O32- + I2 = S4O62- + 2I-),用去该溶液的体积为21.00 mL。求剩余的KIO3为 mol,原KI溶液的物质的量浓度是 mol/L
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
(1)写出MOH的电离方程式:____________________
(2)MOH与HA恰好完全反应时,混合溶液中由水电离出的c(H+)__________0.2mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系B点______________;C点___________;
(4)若D点测得混合溶液的pH=3,则 c(HA)+c(H+)=_____________
甲醇的研究成为当代社会的热点.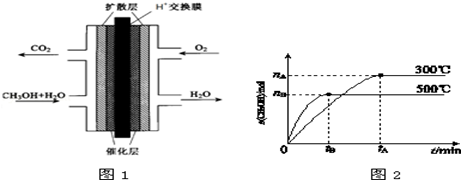
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kP时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为__________.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol﹣1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H2
O2(g)=CO2(g)+2H2(g)△H2
已知H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
则反应②的△H2=__________.
(3)甲醇燃料电池的结构示意图如图1.负极发生的电极反应为____________________.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态.
(1)根据图2,纵坐标为CH3OH的物质的量,升高温度,K值将__________(填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示).
(3)判断该可逆反应达到化学平衡状态的标志是__________(填字母).
a.CO、H2、CH3OH的浓度均不再变化
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.v生成(CH3OH)=v消耗(CO)
e.混合气中n(CO):n(H2):n(CH3OH)=1:2:1
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母).
a.c(H2)减少b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加d.重新平衡时 减小.
减小.
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.(保留四位有效数字)
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_____________。
(2)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为_____________。
(3)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=_____________。
(4)t℃下,KW=1×10-12时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,此溶液中各种离子的浓度由大到小的排列顺序是__________________。
(5) 0.1 mol·L-1的(NH4)2SO4溶液中离子浓度由大到小的顺序为__________。