化学与生产、生活密切相关。从化学视角回答下列问题:
(1)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于____效应,工业上制造光导纤维的基本原料是 。
(2)pH< 的雨水称为酸雨,我国形成酸雨的主要污染物是 。
(3)化工厂曾用浓氨水来检验氯气管道是否漏气,反应原理为(在有水蒸气存在时):2NH3+3Cl2==6HCl+N2。如果氯气管道某处漏气,用该方法检查时的现象是___________。
(4)碳酸氢铵俗称碳铵,是一种廉价氮肥,它的最大缺点是 。如果向碳酸氢铵溶液中滴加NaOH溶液至过量,反应的离子方程式是_____________________。
完成以下离子方程式或化学方程式:
(1)实验室制备氯气的离子方程式
(2)实验室制备氢氧化铝的离子方程式
(3)实验室制备氨气的化学方程式
(4)在实验室制备Fe(OH)2的过程中,常会出现白色沉淀迅速变成灰绿色,缓慢变成红褐色的现象。写出这步变化的化学方程式
现有下列4组物质:
| A.CaO、MgO、CO2、CuO | B.H2、Cl2、N2、Cu |
| C.O2、Fe、Cu、Zn | D.HCl、H2O、H2SO4、HNO3 |
(1)填写下表中的空白
| A组 |
B组 |
C组 |
D组 |
|
| 分类标准 |
金属氧化物 |
金属单质 |
||
| 不属于该类别的物质 |
Cu |
H2O |
(2)若上表中的4种物质相互作用可生成一种新物质——碱式碳酸铜[Cu2(OH)2CO3],写出该反应的化学方程式。
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率(填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是(填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度物质 |
CO |
H2O |
CO2 |
H2 |
| 起始浓度/(mol·L-1) |
2.0 |
x |
0 |
0 |
| 平衡浓度/(mol·L-1) |
0.4 |
6.4 |
1.6 |
1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
(1)把新制的氢氧化铜悬浊液加入到某病人的尿液中并微热,如果观察到红色沉淀,说明尿液中可能含有的物质是()
A.尿酸 B.蔗糖 C. 蛋白质 D.葡萄糖
(2)垃圾处理无害化、减量化和资源化逐渐被人们认识。垃圾的分类收集是实现上述理念的重要措施。某垃圾箱上贴有如图所示的标志,向此垃圾箱中丢弃的垃圾是()
A.危险垃圾 B.有害垃圾 C.可回收物 D.其他垃圾
(3)人类生命活动所需的各种营养主要来自于食物,食物的选择与身体健康关系很大。右表是某位同学的的早餐食谱:
| 主食 |
面包 |
| 副食 |
酱牛肉 |
| 饮品 |
豆浆 |
表中主食含有的营养素主要是(填“糖类”、“油脂”或“蛋白质”,下同);副食含有的营养素主要是, 豆浆所属的分散系为________( 填“溶液”“浊液”或“胶体”)。考虑到营养成分的均衡搭配,你认为应该增加的配菜是。
如下图所示,烧杯中都盛有稀硫酸。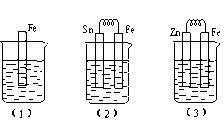
①写出(3)中的电极反应:Fe:、 Zn:。
②比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(填序号)。