镁、铝和锌的混合物与足量的盐酸反应生成氢气2.8 L,则三种金属的总物质的量可能为( )
| A.0.250 mol | B.0.125 mol | C.0.100mol | D.0.080 mol |
.某研究性学习小组为了探究镁粉与溴水反应的机理,做了如下四种实验:①将镁粉投入到冷水中,未观察到明显现象;②将镁粉投入到溴水中,观察到只是开始时产生极少量的气泡,但溴水会慢慢退色;③将镁粉投入到液溴中,未观察到明显现象;④向含有足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快退去。下列关于镁粉与溴水的反应机理的叙述中正确的是
| A.镁粉只直接与溴水中的溴反应 | B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到的 | D.镁粉在水的催化下与溴发生反应 |
将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是
| A.甲装置子中电能转化为化学能 | B.乙装置中电能转化为化学能 |
| C.甲装置中铜片表面有气泡产生 | D.乙装置中铜片表面有气泡生成 |
下列化学用语的书写,正确的是
A.氮气的电子式: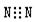 : : : : |
B.硫原子的结构示意图: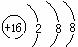 |
C.溴化钠的电子式: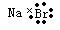 |
D.水分子的结构式: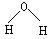 |
某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨溶液,在水浴中加热。实验结果没有银镜产生。其原因是
A.蔗糖尚未水解 B.蔗糖水解的产物中没有葡萄糖
C.加热时间不够 D.煮沸后的溶液中没有加碱,以中和作催化剂的酸
天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式表示为:
CH4+2O2 CO2+2H2O C3H8+5O2 3CO2+4H2O
C3H8+5O2 3CO2+4H2O
现有一套以天然气为燃气的灶具,今改为用液化石油气为燃料,应采取的正确的措施是
| A.增大空气进入量,增大石油气进入量 |
| B.减小空气进入量,减少石油气进入量 |
| C.增大空气进入量,减少石油气进入量 |
| D.减小空气进入量,增大石油气进入量 |