某溶液中含有Na+、Cl-、K+、SO42-四种离子,测得溶液中Na+、K+和SO42-的浓度分别为2mol•L-1 、2mol•L-1 和1mol•L-1 ,则溶液c(Cl-)中为
| A.2mol/L | B.0.5mol/L | C.1.5mol/L | D.1mol/L |
下列操作中,溶液的颜色不发生变化的是
| A.氧化镁固体加入稀盐酸中,完全溶解 |
| B.氢氧化铜加入到稀硫酸中 |
| C.氯化铁溶液中加入足量铜粉,充分振荡 |
| D.氯化铁溶液中滴加硫氰化钾(KSCN)溶液 |
为了除去FeCl3溶液中混有的少量FeCl2,其方法是向此溶液中
| A.加入Fe | B.加入Cu | C.滴加氯水 | D.滴加稀硝酸 |
现在频频出现的大雾天气,致使高速公路关闭,航班停飞。雾中小水滴直径范围是
| A.小于0.1nm | B.大于100nm |
| C.在1nm—100nm间 | D.小于1nm |
室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH变化曲线如图下图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是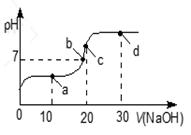
| A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) |
| B.b点时:c( Na+) ="c(" CH3COO-)>c(H+)="c(" OH-) |
| C.c点时:c(OH-)=c(CH3COOH) +c(H+) |
| D.d点时:c(Na+)>c(OH-) >c(CH3COO-)>c(H+) |
在2L的密闭容器中,起始时均投入2molCO,在不同条件下发生反应:CO(g) +2H2(g)  CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
| A.T1<T2 |
| B.同一温度下,n(H2)/n(CO)越大,平衡常数也越大 |
| C.T1℃时该反应的平衡常数为4.0 |
D.相同条件下 越大,CO和H2的转化率也越大 越大,CO和H2的转化率也越大 |