要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为( )
①加入足量氯水②加入足量I2水③加入少量KSCN溶液
| A.①③ | B.③② |
| C.③① | D.①②③ |
在2L的密闭容器中进行如下反应:X2(g)+2Y2(g) 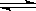 2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是:
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.1mol/L | D.Z为0.4mol/L |
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W;Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为:
| A.X > Z > Y > W | B.Z > W > X > Y | C.Z > Y > X > W | D.Z > X > Y > W |
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是:
| A.10℃ 20mL 4mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的硫酸溶液 2mol/L的硫酸溶液 |
| C.20℃ 40mL 1mol/L的硫酸溶液 | D.20℃ 50mL 3mol/L的盐酸溶液 3mol/L的盐酸溶液 |
下列各组物质中,含有相同的化学键的是
| A.HI和NaI | B.H2S和CO2 | C.Cl2和KCl | D.F2和NaBr |
原子序数为z的元素R,在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是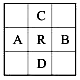
A.4z B.4z+10 C.4z+5 D.4z+14