叠氮化合物应用广泛,如,可用于汽车安全气囊,可用于合成化合物(见下图,仅列出部分反应条件-代表苯基 )
)


 (1)下列说法不正确的是(填字母)
(1)下列说法不正确的是(填字母)
 A.反应①、④属于取代反应
A.反应①、④属于取代反应
 B.化合物I可生成酯,但不能发生氧化反应
B.化合物I可生成酯,但不能发生氧化反应
 C.一定条件下化合物Ⅱ能生成化合物I
C.一定条件下化合物Ⅱ能生成化合物I
 D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
 (2)化合物Ⅱ发生聚合反应的化学方程式为(不要求写出反应条件)
(2)化合物Ⅱ发生聚合反应的化学方程式为(不要求写出反应条件)
 (3)反应③的化学方程式为(要求写出反应条件)
(3)反应③的化学方程式为(要求写出反应条件)
 (4)化合物Ⅲ与发生环加成反应成化合物,不同条件下环加成反应还可生成化合物的同分异构体。该同分异物的分子式为,结构式为。
(4)化合物Ⅲ与发生环加成反应成化合物,不同条件下环加成反应还可生成化合物的同分异构体。该同分异物的分子式为,结构式为。
 (5)科学家曾预言可合成,其可分解成单质,用作炸药。有人通过与,反应成功合成了该物质下。列说法正确的是(填字母)。
(5)科学家曾预言可合成,其可分解成单质,用作炸药。有人通过与,反应成功合成了该物质下。列说法正确的是(填字母)。
 A.该合成反应可能是取代反应
A.该合成反应可能是取代反应
 B. 与甲烷具有类似的空间结构
B. 与甲烷具有类似的空间结构
 C. 不可能与化合物Ⅲ发生环加反应
C. 不可能与化合物Ⅲ发生环加反应
 D. 分解爆炸的化学反应方程式可能为:↑
D. 分解爆炸的化学反应方程式可能为:↑
(1)有机物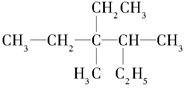 用系统命名法命名:________________________
用系统命名法命名:________________________
(2)写出4甲基2乙基1戊烯的结构简式:________________________
(3)某烃的结构简式是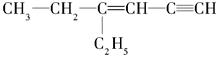 ,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
(4)下列物质中属于同系物的是_________
①CH3CH2Cl②CH2===CHCl③CH3CH2CH2Cl ④CH2ClCH2Cl⑤CH3CH2CH2CH3⑥CH3CH(CH3)2
| A.①② | B.①④ | C.①③ | D.⑤⑥ |
(5)0.1 mol某烷烃燃烧,其燃烧产物全部被碱石灰吸收,碱石灰增39g。该烃的分子式为________;若它的核磁共振氢谱共有3个峰,则该烃可能的结构简式为________。(写出其中一种即可)
(14分)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是(填字母)。
将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量(写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为L(写出计算过程,否则不得分)。
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定某补血剂中铁元素的含量。实验步骤如下: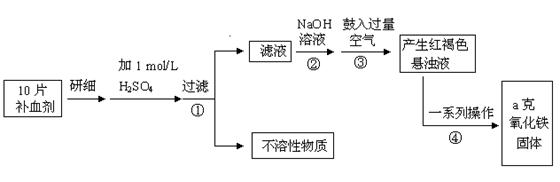
请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为,
步骤③中反应的化学方程式为。
(2)步骤④中一系列处理的操作步骤:、洗涤、、冷却、称量。
(3)若实验中需用98%的浓硫酸(密度为1.84g/mL)配制1 mol/L的稀硫酸480 mL。配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有,需用量筒量取该浓硫酸mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。
B.《有机化学基础》
(1)(4分)按要求回答下列问题:
①下列各组物质互为同系物的是(填字母)》
a.甲醇和甲醛b.乙醇和乙醚 c.乙酸和丙酸
②除去乙酸乙酯中含有的乙酸,最好的处理操作是(填宇母)。
a.蒸馏
b.用过量NaOH溶液洗涤后分液
c.用过量Na2C03溶液洗涤后分液
③下列化合物属于酚类的是(填字母)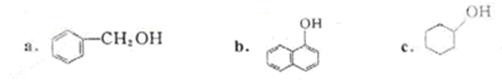
④胡椒粉是植物挥发油中的一中成分。关于胡椒粉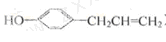 的下列说法中正确的是。(填字母)
的下列说法中正确的是。(填字母)
a.该化合物属于芳香烃
b.分子中至少有7个碳原了.处于同一平面
c.1 mol该化合物最多可与2 mol Br2发生反应
(2)(5分)今有化合物: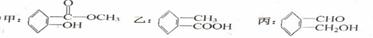
①写出甲中含氧官能团的名称、。
②请判断上述哪些化合物互为同分异构体。
③写出乙与NaHC03溶液反应的化学方程式:。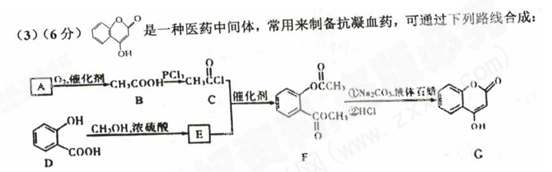
①A与银氨溶液反应有银镜生成,则A的结构简式是。
②B—C的反应类型是。
③E的结构简式是。
④写出F和过量NaOH浓液共热时反应的化学方程式。
⑤下列关于G的说法不正确的是。
a.能与溴水反应
b.能与金属钠反应
c.1 mol G最多能和5 mol氢气反应
d.分子式是C9H603
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题, 选学《有机化学基础》模块的考生.答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》:
(1)、(4分)良好的生态环境可以提升生活质量。
①提倡“光盘行动”,有利于“勤俭节约”、减少厨余垃圾,厨余垃圾的标识为_(填宇母)。
②下列物质中,不能用于饮用水杀菌消毒的是_(填字母)。
a.漂白粉b.乙醇c.二氧化氯
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是_(填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金厲离子
c.用氯气除去废水中的悬浮物
④某地区各空气污染物指数为S0278、NO2 43、可吸入颗粒物153。该地K的首要污染物为_ 。
(2)、(6分)保证食品安全,合理用药,是人体健康的基础。
①营养平衡、科学使用食品添加剂有助于健康和提髙免疫力。下列物质常用作食品防腐剂的是_(填字母)。
a.苯甲酸钠 b.味精c.柠橡黄
②下列药品属F国际奥委会严格禁止的兴奋剂是_(填字母)。
a.阿司匹林 b.青霉素 c.吗啡
③氨基酸分子中含有的官能团是氨基(一NH2)和_(写名称)。人体中共有 20多种氨基酸,其中人体自身_(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
④如何检验糖尿病患者的尿液中含有葡萄糖?写出实验操作方法、现象和结论:_
(3)、(5分)化学与材料密切关联。
①下列塑料可用作不粘锅的表血材料的是(填字母)。
a.聚氯乙烯b.聚四氟乙烯 c.有机玻璃
②下列关于铁制品保护措施的说法中不正确的有(填字母)。
a.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
b.将不锈钢制成刀其和餐具,有的刀具还进行烤蓝处理
c.在海轮的外壳上常焊有铜块,且定期更新
③钢筋泡凝土属于材料。(填字母)
a.复合材料b.无机非金属材料c.金属材料
④氧气和四氯化硅蒸气在旋转的岛温炉中发生罝换反应,其产物之一可制得光导纤维,试写出该反应的化学方程式。