(1)有机物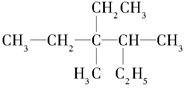 用系统命名法命名:________________________
用系统命名法命名:________________________
(2)写出4甲基2乙基1戊烯的结构简式:________________________
(3)某烃的结构简式是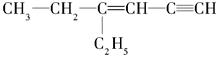 ,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
(4)下列物质中属于同系物的是_________
①CH3CH2Cl ②CH2===CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3 ⑥CH3CH(CH3)2
| A.①② | B.①④ | C.①③ | D.⑤⑥ |
(5)0.1 mol某烷烃燃烧,其燃烧产物全部被碱石灰吸收,碱石灰增39g。该烃的分子式为________;若它的核磁共振氢谱共有3个峰,则该烃可能的结构简式为________。(写出其中一种即可)
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 ( L )+2N2O4 (L )=2CO2 (g)+3N2(g)+4H2O(g)(Ⅰ)
(1)该反应(Ⅰ)中还原剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 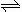 2NO2 (g)(Ⅱ)
2NO2 (g)(Ⅱ)
一定温度下,反应(Ⅱ)的焓变为ΔH。现将2 mol NO2 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________.
若在相同温度下,上述反应改在体积为3L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应4s后N2O4的物质的量为0.9mol,则0~4s内的平均反应速率v(NO2)=_________________。
(3)25℃时,将1mol NH4NO3溶于水,溶液显酸性,原因是_____(用离子方程式表示)。向该溶液滴加50mL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将_______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为____mol·L-1。(NH3·H2O的电离平衡常数K=2×10-5 mol·L-1)
[化学—选修3:物质结构与性质]
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式。
(2)B、C、D三种元素第一电离能由小到大的顺序为(用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为,分子的立体结构为;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式。
(4)A2D的沸点在同族元素中最高,其原因是。A2D由液态形成晶体时密度(填“增大”、“不变”或“减小”),其主要原因(用文字叙述)。
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为g·cm-3(用含a、NA的符号表示)。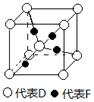
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:
①C(s) + H2O(g) === CO(g)+H2(g)ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g)ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为。
该反应在(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
| 时间(min) 浓度(mol·L-1) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①10~20min内,N2的平均反应速率v(N2)=。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母序号)。
A.通入一定量的NOB.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
选考[化学—有机化学基础](13分)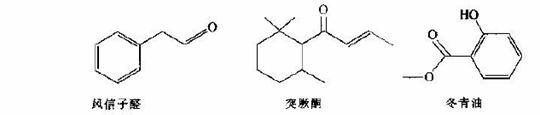
(1)可鉴别风信子醛和突厥酮的试剂是。
(2)下列关于风信子醛和突厥酮的说法中正确的是(填序号)。
a.都属于芳香族化合物b.都能使酸性高锰酸钾溶液褪色
c.突厥酮的分子式为C13H20Od风信子醛不能发生加成反应
(3)突厥酮与嗅水反应的化学方程式为。
(4)芳香烃A发生如下反应生成F: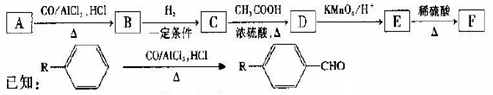
F与冬青油互为同分异构体。请回答:
①若A的分子式为C10 H14,则能实现上述转化的A的同分异构体有种
②C→D的反应类型为。
③设汁C→D和E→F步骤的目的为。
④F生成高聚物的化学方程式为。
选考〔化学—物质结构与性质](13分)
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,
反应原理为: 2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)基态锰原子的核外电子排布式为_
(2)上述反应涉及的元素属于同主族元素,其第一电离能由大到小的顺序为(填元素符号)。
(3)已知H2.S2O8的结构如图。
①H2.S2O8硫原子的轨道杂化方式为。
②上述反应中被还原的元素为。
③上述反应每生成1 mol MnO4 -,S2O82- 断裂的共价键类型及其数目为。
(4)一定条件下,水分子间可通过O一H...O氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体
①下图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为;
②实验测得冰中氢键的作用能为18.8目kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是。