1985年,科学家发现C60分子是由60个碳原子构成的,它的形状像足球(图C),因此又叫足球烯。1991年科学家又发现一种碳的单质——碳纳米管,它是由六边环形的碳原子构成的管状大分子(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。

试回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管物理性质存在较大差异的原因是 。
(2)常温下足球烯和碳纳米管的化学性质是否比金刚石和石墨活泼?____________(填“活泼”和“一样”)理由是 。
(3)由下边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C原子数与C—C键数之比为 。
(4)在金刚石的网状结构中,含有共价键形成的碳原子环,其中最小的环上有_____(填数字)个碳原子,每个碳原子上的任两个C—C键的键角都是 (填角度)。
(5)燃氢汽车之所以尚未大面积推广,除较经济的制氢方法尚未完全解决外,还需解决制得H2后的贮存问题,在上述四种碳单质中有可能成为贮氢材料的是 。
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡 常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。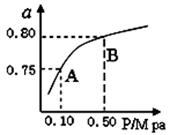
则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,
若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和H2O等为原料制取NaHCO3,然后再将NaHCO3灼烧制成Na2CO3。若灼烧的时间较短,NaHCO3分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究:取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。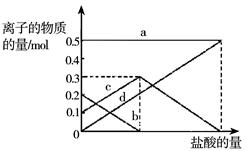
(1)则曲线d对应的溶液中的离子是 (填离子符号下同);曲线b对应的溶液中的离子是;该样品中NaHCO3和Na2CO3的物质的量之比是;
(2)若取42.0 g NaHCO3 固体,加热了t2 min后,剩余固体的质量为29.6g。如果把剩余固体全部加入到400 mL 2mol·L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为(设溶液体积变化忽略不计)
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。目前,人们利用光能和催化剂,可将CO2和H2O(g)转化为CH4和O2。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内CH4的平均反应速率为。平衡后可以采取下列的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内CH4的平均反应速率为。平衡后可以采取下列的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知: CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式。
②该反应的△S0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是(填字母);理由是。列式计算270℃时该反应的平衡常数K:。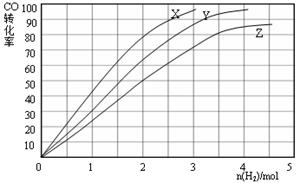
(4)以燃料电池为工作原理测定CO的浓度,其装置如图所示,
该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。则负极的反应式。
关于该电池的下列说法,正确的是。
A.工作时电极b作正极,O2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中CO的含量越高
某种物质溶于水后得到的溶液中,含有K+、Fe2+、Al3+、SO42-、NH4+、Ba2+、CO32-、NO3-离子中的某几种。
(1)甲同学欲探究溶液的组成,进行了如下实验:①取少量溶液于试管中,逐滴加入浓氢氧化钠溶液至过量,发现开始生成白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,加热有刺激性气体放出,过滤;②取滤液通入过量CO2气体,出现白色沉淀。
该溶液中一定含有的离子是;写出②中生成白色沉淀的离子方程式。
(2)乙同学进行如下实验:取少量溶液于试管中,滴加几滴硫氰化钾溶液,无明显现象;再滴加H2O2,发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,乙同学查阅资料知:H2O2+SCN-→SO42-+CO2↓+N2↑+H2O+H+
①该反应中,被氧化的元素为,每生成lmol CO2转移的电子数为NA;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确。
某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出A的化学式。
(2)写出气体C通入H2O2中反应的离子方程式。
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式。
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理理由是。
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物。