以磷石膏(只要成分
,杂质
、
等)为原料可制备轻质
。

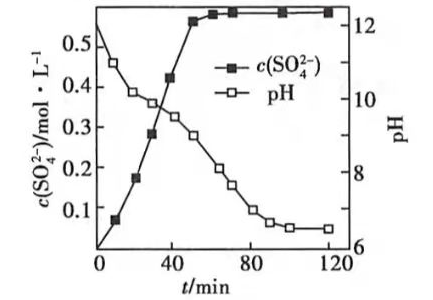
(1)匀速向浆料中通入
,浆料清液的
和
随时间变化见由下图。清液
时
转化的离子方程式;能提高其转化速率的措施有(填序号)
| A. | 搅拌浆料 | B. | 加热浆料至100℃ |
| C. | 增大氨水浓度 | D. | 减小 通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为和(填化学式);检验洗涤是否完全的方法是。
(3)在敞口容器中,用
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
增大的原因。
芳香化合物A、B互为同分异构体,B的结构简式是CH3COO- -COOCH2CH3
-COOCH2CH3
A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示: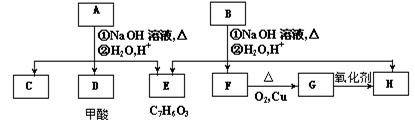
(1)B可以发生的反应类型有(填序号)。
①加成反应②酯化反应③消去反应④取代反应⑤聚合反应
B的核磁共振氢谱中会出现_______个峰。
(2)E中含有官能团的名称是。
(3)A有两种可能的结构,其对应的结构简式为,。
(4)B、C、D、F、G化合物中互为同系物的是。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为;砷与溴的第一电离能较大的是。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为,与其互为等电子体的一种分子为。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为,As原子采取杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与个Ga相连,As与Ga之间存在的化学键有(填字母)。
| A.离子键 | B.氢键 | C.配位键 | D.金属键 E.极性键 |
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)一定条件下,在一个密闭容器中充入气体:N2 2mol、H2 6mol,达平衡后N2的转化率为50%,同时放热92.3KJ。该反应的热化学方程式为:______________________________。
(2)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2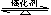 2NH3。
2NH3。
①该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据,(填温度和压强)。时H2转化率最高,实际工业生产中不选用该条件的主要原因是。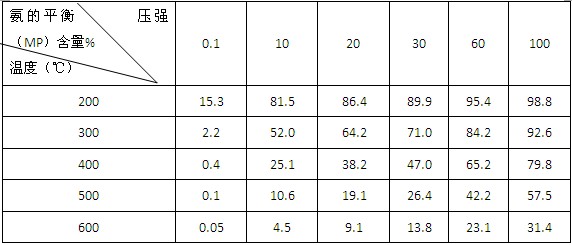
③下列关于合成氨说法正确是(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(3)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,你认为电解质溶液应显性(填“酸性”、“中性"、“碱性”),写出负极电极反应式。
(4)工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为mol/L。
(14分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下: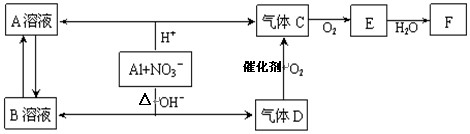
已知,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1) A和B两溶液混合产生白色沉淀,该白色沉淀的化学式
(2) C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式
(3)完成铝在碱性条件下与NO3-反应的离子方程式。
(4)过量D的水溶液与A溶液反应的离子方程式是。
(5)D→C反应的化学方程式是。
(6)除去气体C中的杂质气体E的化学方法:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是。
聚合硫酸铁又称聚铁,化学式为 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是___。
(2)制备绿矾时,向溶液X中加入过量___,充分反应后,经_____操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为____。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_____。
(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:
。
(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680 kg 绿矾和560 kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料____________________kg。