设X、Y、Z代表三种元素。已知:
(1)X+和Y-两种离子具有相同的电子层结构;
(2)Z元素的原子核内质子数比Y元素的原子核内质子数少9个;
(3)Y和Z两种元素可以形成4核42个电子的-1价阴离子。
据此完成下列各空:
(1)Y元素的名称是___________元素,Z元素的元素符号为___________。
(2)X元素原子的结构示意图为___________。
(3)由X、Y、Z三元素所形成的68个电子的盐类化合物的化学式是__________________。
(4)写出由X、Y、Z三元素所形成的60个电子的盐分解反应的化学方程式______________。
对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1:1。
回答下列问题:
(1)A的化学名称为;
(2)由B生成C的化学方程式为,该反应类型为_;
(3)D的结构简式为;
(4)F的分子式为;
(5)G的结构简式为;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有种,其中核磁共振氢谱三种不同化学环境的氢,且峰面积比为2:2:1的是(写结构简式)。
在下列物质中是同系物的有;互为同分异构体的有;互为同素异形体的有;互为同位素的有;互为同一物质的有;
(1)液氯(2)氯气 (3)白磷 (4)红磷(5)氕 (6)氚
(7) 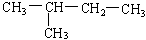 (8)
(8) 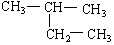
(9)CH2 = CH-CH3(10) 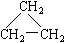 (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷
在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=已知: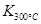 >
>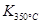 ,则该反应是热反应。
,则该反应是热反应。
(2)图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。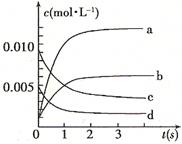
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
在2L密闭容器中充入1mol H2和1mol I2蒸气,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)==2HI(g) △H<0达到平衡时候n(H2)为0.8mol
(1) 保持容器容积不变,向其中加入1molH2,反应速率(填加快、减慢、不变、不确定),理由是。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率(填加快、减慢、不变、不确定),理由是。平衡(正向或逆向或不)移动
(3)计算该温度下的平衡常数
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: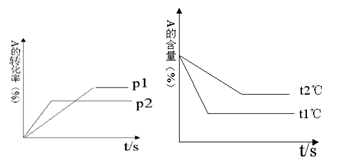
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);
(4)正反应为反应。