在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
| A.2H2(g)+O2(g)====2H2O(g) ΔH=-Q2 kJ·mol-1; 2H2(g)+O2(g)====2H2O(l) ΔH=-Q1 kJ·mol-1 |
| B.S(g)+O2(g)====SO2(g) ΔH=-Q1 kJ·mol-1; S(s)+O2(g)====SO2(g) ΔH=-Q2 kJ·mol-1 |
C.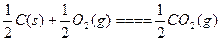 ΔH=-Q1 kJ·mol-1; ΔH=-Q1 kJ·mol-1;C(s)+O2(g)====CO2(g) ΔH=-Q2 kJ·mol-1 |
| D.H2(g)+Cl2(g)====2HCl(g) ΔH=-Q1 kJ·mol-1; |
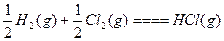 ΔH=-Q2 kJ·mol
ΔH=-Q2 kJ·mol
某分子式为C8H16O2的酯,在一定条件下可发生如下图的转化过程:
则符合上述条件的酯的结构可有
| A.1种 | B.2种 | C.3种 | D.4种 |
有机物A的结构简式如右图所示,下列有关该物质的说法正确的是: 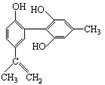
| A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2 和H2分别为4 mol、7 mol |
| D.该分子中的所有碳原子不可能共平面 |
为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是
| 选项 |
物质 |
除杂试剂 |
分离方法 |
| A |
乙酸乙酯(乙酸) |
NaOH溶液 |
分液 |
| B |
甲烷(乙烯) |
酸性KMnO4溶液 |
洗气 |
| C |
苯(苯酚) |
浓溴水 |
过滤 |
| D |
乙醇(乙酸) |
NaOH溶液 |
蒸馏 |
下列实验能获得成功的是
| A.将乙醛滴入银氨溶液中,加热煮沸制银镜 |
| B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量硫酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素 |
| C.向浓苯酚中加几滴稀溴水观察到沉淀 |
| D.取2mL 1mol·L-1CuSO4溶液于试管中,加入10mL 2mol·L-1NaOH溶液,在所得混合物中加入40%的乙醛溶液,加热得到砖红色沉淀 |
有机物结构理论中有一个重要的观点:有机物分子中原子间或原子团间可以产生相互影响,从而导致化学性质的不同,以下的事实不能说明此观点是
| A.ClCH2COOH的酸性比CH3COOH酸性强 |
| B.丙酮分子(CH3COCH3)中的氢原子比乙烷分子中的氢原子更易发生卤代反应 |
| C.HOOCCH2CHO既能发生银镜反应又能发生酯化反应 |
| D.苯酚能与NaOH溶液反应而乙醇则很难 |