本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
下列叙述中正确的是()
A.(CH3)2C CHCH2CH3中所有碳原子共面 CHCH2CH3中所有碳原子共面 |
| B.苯不能使酸性高锰酸钾溶液褪色,证明苯分子中不存在单双键交替的结构 |
| C.聚乙烯能使溴水褪色 |
| D.甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中 ②先将铜与O2反应生成CuO,再溶于硝酸中 ③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断中错误的是( )
| A.方法③是最经济和环保的 |
| B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好 |
| C.方法②需要消耗能源,对环境不产生污染 |
| D.方法③中N2O4既是氧化剂又是还原剂 |
利用常温下氨与氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图所示。下列有关说法中错误的是( )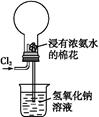
| A.烧瓶中立即出现白烟 |
| B.烧瓶中立即出现红棕色气体 |
| C.烧瓶中发生的反应表明常温下氨气有还原性 |
| D.烧瓶中还发生了化合反应 |
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法中正确的是( )
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 |
a |
b |
c |
| A |
Al |
AlCl3 |
Al(OH)3 |
| B |
HNO3 |
NO |
NO2 |
| C |
Si |
SiO2 |
H2SiO3 |
| D |
NH3 |
NO2 |
NO |