(1)有机化合物A、B分子式不同,它们只可能含C、H、O元素中的两种或三种。如果将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧时消耗O2和生成H2O的物质的量也不变。那么A、B组成必须满足的条件是______________。若A为CH4,则符合上述条件的B中相对分子质量最小的是______________ (写分子式),并写出相对分子质量最小且含甲基的B的两种同分异构体的结构简式______________、______________。
(2)一定量的乙醇在氧气不足时燃烧,得CO2、CO和H2O共27.6 g,若其中水为10.8 g,则CO的质量为______________。
A.1.4 g B.2.2 g C.4.4 g D.2.2 g和4.4 g之间
已知:A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,B、C、D三种元素的最高价氧化物对应的水化物分别为X、Y、Z,X、Y、Z可两两相互反应生成盐和水,试推断并用相应的化学用语回答下列问题。
(1)D元素原子的结构示意图为;
(2)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为
;
(3)A、B、C三种元素的原子半径由小到大的顺序为;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈(填“酸”、“碱”或“中”)性 ,该水溶液中各离子浓度由小到大的顺序为
,该水溶液中各离子浓度由小到大的顺序为 。
。
A:下面所列的是中学化学实验室中几种常见的玻璃仪器:
①温度计、②容量瓶、③滴定管、④烧杯、⑤蒸馏烧瓶、
⑥ 量筒、⑦玻璃棒、⑧蒸发皿
量筒、⑦玻璃棒、⑧蒸发皿
在仪器上具体标明使用温度的是(不考虑温度计) (填编号);
标有“0”刻度的有 (填编号)
对允许加热的仪器,加热时必须垫上石棉网的有 (填编号);
使用时必须检查是否漏水的有 (填序号);
B:现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是;
②右图是酸式滴定管中液面在滴定前后的读数:则c (NaOH)= ;
C:拟在烧杯中于加热条件下配置某溶液50mL,应选择的烧杯是(用字母回答)
| A.400mL | B.250mL | C.100mL | D.50 ml |
D:“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管②分液漏斗③细口试剂瓶④广口试剂瓶⑤集气瓶⑥滴瓶肯定用不到“磨砂”处理的有 (填序号)。
(8分)有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)。回答下列问题: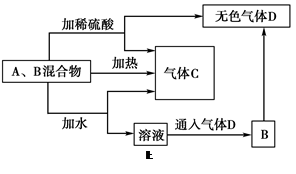
(1)写出A的电子式____________。
(2)①E溶液加少量稀硫酸的化学方程式_______________________________。
②B加稀硫酸产生D的离子方程式_______________________________。
(3)请用化学方程式表示A在潜水艇中的一种重要用途__________________________。
用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:
(1)计算机芯片的主要成分是(填化学式,以下同);
(2)光导纤维的主要成分是:
(3)目前应用最多的太阳能电池的光电转化材料是;
在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是。试解释易拉罐变瘪的原因;并解释后一现象的原因。写出反应过程中的两个离子方程式;。