能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式的简化形式 。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。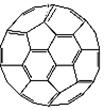
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②二氧化硒分子的空间构型为 。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
 |
|||||||||||||||||
| A |
B |
C |
|||||||||||||||
| D |
E |
||||||||||||||||
| N |
M |
Q |
|||||||||||||||
⑴A、B、C原子的第一电离能由小到大的顺序是__________(用元素符号表示);
Q元素基态原子电子排布式为。
⑵写出BC2+的电子式,1mol BC2+中含有的π键数目为。
⑶化合物甲由B、D两元素组成,已知甲是一种重要的结构材料,硬度大,耐磨损,晶胞如图1所示甲的晶体中B、D两种元素原子的杂化方式均为。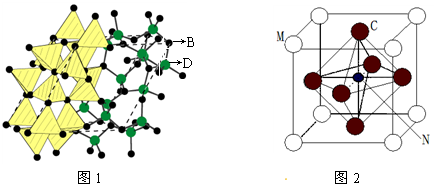
⑷法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔因在巨磁电阻效应(CMR效应)研究方面的成就而获得诺贝尔物理学奖。如图2的化合物具有CMR效应,则该化合物的化学式为。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g)  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+ O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
⑴反应Ⅰ的焓变△H1=。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4=。
与CO和H2相比,甲醇作为汽车动力燃料的优点是
。
⑶反应Ⅰ的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。
既能提高产率,又能提高反应速率的措施是。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化 学式)
学式)
②负极的电极反应式为。
还原铁粉是粉末冶金工业的重要原料,利用生产钛 白的副产品绿矾制备还原铁粉的工业流程如下:
白的副产品绿矾制备还原铁粉的工业流程如下: 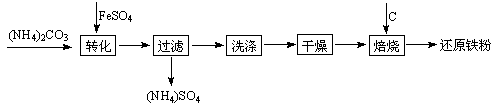
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
下图所示转化关系中,B、C、F都是单质,其中C是紫红色固体,F是银白色固体,B是空气的主要成分之一;化合物G是常用的耐火材料,D溶液中加入氯化钡溶液,产生白色沉淀。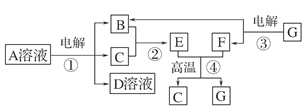
试回答下列问题:
⑴反应①~④中,属于置换反应的是________(填序号)。
⑵写出反应①的化学方程式:_____________________________________________。
⑶G与D溶液反应的离子方程式__________________________________________。
⑷生成等物质的量的B时,反应①和③消耗的A、G的物质的量之比为________。
⑸用C、F作两电极,并用导线相连:
①两电极同时插入稀H2SO4中,F上的电极反应式为
__________ __________________________________________________________。
__________________________________________________________。
②两电极同时插入浓HNO3中,F上的电极反应式为
____________________________________________ ________________________。
________________________。
在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需 加入过
加入过 量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤: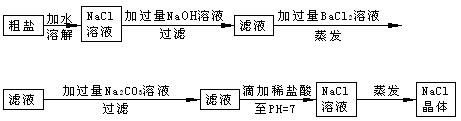
试简要说明:
(1)加入过量BaCl2的溶液的原因_______。
(2)判断BaCl2已过量的方法是
(3)加入过量Na2CO3的溶液的原因___________。
(4)滴加稀盐酸直至pH=7的目的是_________;
写出这时反应的化学方程式