除去高压锅炉用水中溶解的氧气,常用的试剂有N2H4(肼)、Na2SO3。
(1)写出两种试剂和O2反应的化学方程式:
① ;② 。
(2)除去等质量的O2,所耗N2H4(摩尔质量为32g/mol)、Na2SO3(摩尔质量为126g/mol)质量之比为 。
(3)和N2H4相比,使用Na2SO3除氧的缺点是 。
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是________________________________。
(3)第⑤步实验的操作是________________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.量取浓硫酸的量筒用蒸馏水洗涤后倒入烧杯__________
E.量取浓硫酸时俯视读数
F.定容时俯视刻度线_____________
某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示):
(1)下面他的操作应该是______________________,使_________________。
(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号)
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱。
【提出假设】
假设1:;
假设2:;
假设3:Fe2+和I-的还原性一样强。
【验证假设】
⑴利用以下装置进行试验,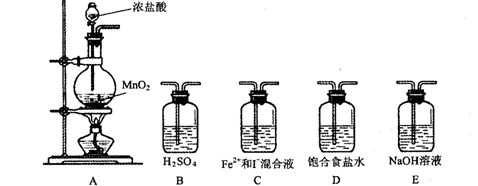
实验必需的装置是:A (按氯气流向的顺序用序号书写)
(按氯气流向的顺序用序号书写) ⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,(能或不能)判断反应的先后顺序。
⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,(能或不能)判断反应的先后顺序。
⑶请在下表中填写实验步骤及预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加; 向B试管中滴加: |
①若 则假设1成立 ②若 则假设2成立 ③若 则假设3成立 |
⑷该实验成功的关键是控制各反应物的用量。该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设,通入的氯气的体积最多不能超过。(标准状况)
⑸有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小。并不能证明Fe2+和I-的还原性强弱。于是提出另一验证方案:往KI溶液中滴加溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是。
回答酸碱滴定实验中的下列问题:
(1)下列有关滴定操作的顺序正确的是_______
①检查滴定管是否漏水②用蒸馏水洗涤玻璃仪器③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管④滴定操作⑤装标准溶液和待测液并调整液面(记录初始读数)⑥取一定体积的待测液于锥形瓶中,并滴加指示剂
A.①③②④⑤⑥ B.①②③⑤⑥④ C.②③①④⑤⑥ D.④⑤①②③⑥
(2)下图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积是__________mL。
(3)下图Ⅱ表示25.00 mL滴定管中 液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_
液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_ _________。
_________。
A.a mL B.(25—a) mL C.大于a mL D.大于(25—a)mL
(4)上图Ⅲ为用一标准浓度NaOH溶液滴定20.00 mL未知浓度的盐酸时的滴定曲线。则两种溶液的物质的量浓度分别是:c(HCl)=________,c(NaOH)=_______________。
(5)滴定过程中,下列操作中会使测定结果偏低的有____________
A.酸式滴定管未润洗 B.锥形瓶内有少量水
C.滴定前,滴定管尖嘴部分有气泡, 滴定后气泡消失
滴定后气泡消失
D.滴定前仰视滴定管读数,滴定后平视刻度读数
实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为。
实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含m mol NaOH的溶液及过量的MnSO4 溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴作指示剂。
⑧用0.005 mol · L-1Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1)。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈(填“酸性”、“碱性”或“接近中性”),其原因是。