某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱。
【提出假设】
假设1: ;
假设2: ;
假设3:Fe2+和I-的还原性一样强。
【验证假设】
⑴利用以下装置进行试验,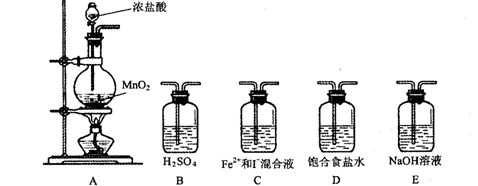
实验必需的装置是:A (按氯气流向的顺序用序号书写)
(按氯气流向的顺序用序号书写) ⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化, (能或不能)判断反应的先后顺序。
⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化, (能或不能)判断反应的先后顺序。
⑶请在下表中填写实验步骤及预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 ; 向B试管中滴加 : |
① 若 则假设1成立 ② 若 则假设2成立 ③ 若 则假设3成立 |
⑷该实验成功的关键是控制各反应物的用量。该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设,通入的氯气的体积最多不能超过 。(标准状况)
⑸有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小。并不能证明Fe2+和I-的还原性强弱。于是提出另一验证方案:往KI溶液中滴加 溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是 。
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A装置可以重复使用。
请回答下列问题:
(1)请按气体流向连接实验装置→→→d→→→→ g(用仪器接口编号填写)。
(2)B装置中制O2时所用的药品是。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是;停止加热后,也要再通一段时间的氧气,目的是。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式。 (4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
实验一:X在一定条件下可催化氧化最终生成有机物Y.
实验二:X与Y在浓硫酸加热条件下生成有机物Z.
则①写出实验二中反应的化学方程式。
②除去Z中混有的Y所需的试剂和主要仪器是、。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式。
氯化铁是常见的水处理剂。某氯化铁 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:
已知有关离子方程式为:
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:_____________________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准 溶液18.00mL。该样品中
溶液18.00mL。该样品中 (式量为270.5)的质量分数为_____________。
(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量 杂质除去,可用的试剂是________(选填编号)。
杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品②加水溶解③加足量氨水,沉淀④过滤⑤灼烧⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作________________________;
判断是否恒重的标准是_______________________________________________________。
分以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下: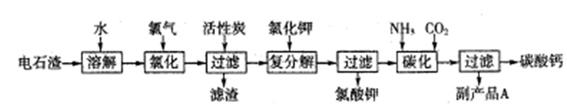
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
(2)氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为:
(3)该流程中加入活性炭的作用是
(4)碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、→ 、→i。其中与i相连漏斗的作用是。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是(填编号)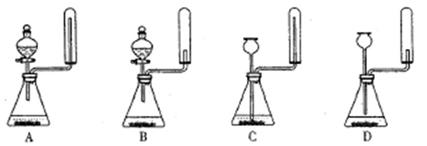
(5)副产品A的化学式为 。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: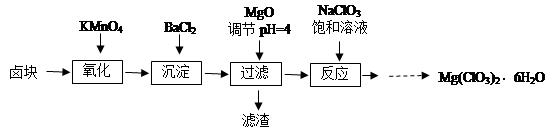
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。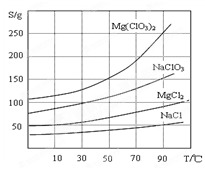
(1)过滤所需要的主要玻璃仪器有。
(2)加入BaCl2的目的是,加MgO后过滤所得滤渣的主要成分为。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:;
②产品中Mg(ClO3)2·6H2O的质量分数为。
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL容量瓶中定容成250mL烧碱溶液; |
| B.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品mg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为C mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)

 D
D  。
。
(2)操作E中的锥形瓶下垫一张白纸的作用是。
(3)操作D中液面应调整到 。
(4)滴定终点的现象是。
(5)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响?(填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(6)该烧碱样品的纯度计算式是。