漂白粉在生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)1998年,我国长江流域和松花江流域都发生了百年不遇的特大洪水。灾区人们的饮用水,必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会失效。试用化学方程式表示漂白粉在空气中易失效的原因:① ;② 。
(2)已知浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)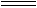 CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是()
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④ C.②③ D.①④
(3)用Cl2和石灰乳制作漂白粉的目的是()
A.转变为较HClO稳定且易储运的物质
B.转变为更易溶于水的物质
C.提高氯气的利用率
D.增强漂白能力
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g) CH3OH (g)
CH3OH (g) H1
H1
反应Ⅱ:CO2(g)+ 3H2(g) CH3OH (g)+H2O(g)
CH3OH (g)+H2O(g) H2
H2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断H1_______________0(填“>”、“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为______________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式_______。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) |
2 |
4 |
1 |
3 |
| H2的初始浓度(mol/L) |
3 |
2 |
3 |
3 |
| 时间(min) |
8 |
6 |
12 |
n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为L。
选做【化学—有机化学基础】呋喃酚是合成农药的重要中间体,其合成路线如下:
(1)A物质核磁共振氢谱共有个峰,B→C的反应类型是。
(2)已知x的分子式为C4H7C1,写出A→B的化学方程式:。
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是。
(4)下列有关化合物C、D的说法正确的是。
①可用氯化铁溶液鉴别C和D②C和D含有的官能团完全相同
③C和D互为同分异构体④C和D均能使溴水褪色
(5)E的同分异构体很多,写出一种符合下列条件的芳香族同分异构体的结构简式:。
①环上的一氯代物只有一种②含有酯基③能发生银镜反应
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.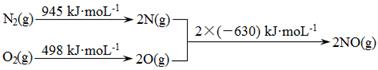
II.N2(g)+ O2(g)  2NO(g)ΔH1
2NO(g)ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2=" -565" kJ·mol-1
2CO2 (g) ΔH2=" -565" kJ·mol-1
①ΔH1=。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式。
(2)电化学气敏传感器法测定汽车尾气。其中CO传感器的工作原理如图所示,则工作电极的反应式为
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因。
(4)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是(选填字母)。
a.容器内压强不再变化 b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化 d.生成CO2的速率与消耗CO的速率相等
②l0 min内,反应的平均反应速率v (CO2)=。
③T℃时,该反应的平衡常数K=。
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑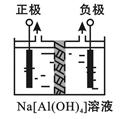
(1)产物Al(OH)3在区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是。
(5)往溶液中加入H2O2的作用是(用离子方程式表示)。
(6)加入的X试剂(填选项编号)是。
| A.CuO | B.Al(OH)3 | C.NaOH | D.NaHCO3 |
若调节后溶液的pH偏离3.5,可能带来的后果是。
选做【化学——有机化学基础】(12分)枯茗醛可用作食用香精。现由枯茗醛合成兔耳草醛,其合成路线如下:
已知醛在一定条件下发生如下反应:
请回答下列问题:
(1)写出试剂X的结构简式:____________。
(2)写出有机物B中所含官能团的名称为_____________;A→B的反应类型为__________。
(3)检验B中的官能团所需的试剂是_________(填序号)。
| A.银氨溶液 稀盐酸 溴水 |
| B.新制氢氧化铜悬浊液稀硫酸酸性高锰酸钾溶液 |
| C.新制氢氧化铜悬浊液 稀盐酸 溴水 |
| D.银氨溶液稀硫酸酸性高锰酸钾溶液 |
(4)写出有机物C生成兔耳草醛的化学方程式:_________________________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的苯环上只存在一种化学环境的氢原子;
写出Y可能的结构简式:_____________、______________。