将2.80 g CaO与500 mL某浓度的盐酸充分反应,将所得溶液平均分成两份。向其中一份中加入足量的AgNO3溶液,生成的沉淀干燥后的质量为14.4 g;向另一份溶液中加入足量Zn粒,产生0.560 L(标准状况)气体。计算所用盐酸中HCl的物质的量浓度。
BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。计算原混合溶液中的c(Na+)/mol·L-1。
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将M1克样品加热,其质量变为M2克,求该样品的纯度(质量分数)。
实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少? (2)剩余HCl的物质的量为多少?
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)参加反应的NH3和作为还原剂的NH3的个数比为多少?
(2)若标准状况下33.6LCl2参加反应则被氧化的NH3的质量为多少?将还原产物溶于水配成500ml溶液其物质的量浓度为多少? (有计算步骤)
实验室常用浓盐酸与二氧化锰反应制取少量氯气,反应的化学方程式为:
4HCl(浓) +MnO2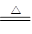 MnCl2+2H2O+Cl2↑,取足量12 mol·L-1浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为4.48L。计算(写出具体计算过程)
MnCl2+2H2O+Cl2↑,取足量12 mol·L-1浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为4.48L。计算(写出具体计算过程)
(1)被氧化的HCl的物质的量 (2) 参加反应的MnO2的质量