将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:
①3H2S+2HNO3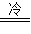 3S↓+2NO↑+4H2O
3S↓+2NO↑+4H2O
②H2S+2HNO3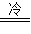 S↓+2NO2↑+2H2O
S↓+2NO2↑+2H2O
③4H2S+2HNO3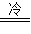 4S↓+NH4NO3+3H2O
4S↓+NH4NO3+3H2O
④5H2S+2HNO3====5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序是 ( )
| A.①>②>③>④ |
| B.②>①>④>③ |
| C.②>①>③>④ |
| D.④>③>①>② |
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应
Si(s)+4HCl(g),该反应的反应 热△H为( )
热△H为( )
| A.+412 kJ·mol-1 | B.-412 kJ·mol-1 |
| C.+236 kJ·mol-1 | D.-236 kJ·mol-1 |
已知反应:
①25℃、101kP a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是()
| A.N2H4的燃烧热大于534 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量 |
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有()
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+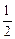 O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+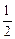 O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+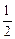 O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
在一含Na+的澄清溶液中,可能还 存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ()
存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ()
| A.溶液中一定存在Br-、CO32- | B.溶液中可能存在NH4+ |
| C.溶液中一定不存在Fe2+、I-、SO32- | D.溶液一定呈碱性 |
直接NaBH 4/H 2O 2燃料电池(DBFC)的结构如下图: 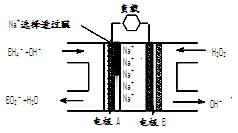
有关该电池的说法正确的是
A.电极B材料中包含MnO 2层,MnO 2可起催化作用
B.电池负极区的电极反应为:BH 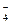 +8OH ――8e -=BO
+8OH ――8e -=BO 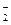 +6H 2O
+6H 2O
C.放电过程中,Na +从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH 2O 2溶液,理论上流过电路中的电子为6N A个