把Mmol H2和N mol C2H4混合,在一定条件下使它们一部分发生反应生成W mol C2H6将反应后的混合气体完全燃烧,消耗氧气的物质的量 为()mol
为()mol
| A.M+3N | B.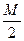 +3N +3N |
C.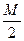 +3N+ +3N+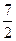 W W |
D.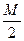 +3N— +3N—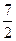 W W |
下列各物质的名称正确的是()
| A.3,3-二甲基丁烷 | B.2,3,3-三甲基丁烷 |
| C.2,2-二甲基-3-乙基丁烷 | D.2,3-二甲基-4-乙基己烷 |
某气态烃10 mL与50 mL氧气在一定条件下作用,刚好耗尽反应物,生成水蒸气40 mL、一氧化碳和二氧化碳各20 mL(各体积都是在同温同压下测得)。该气态烃为()
| A.C3H8 | B.C4H6 | C.C3H6 | D.C4H8 |
在25℃时将pH=11  的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是 ()
的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是 ()
| A.c (Na+)==c(CH3COO-)+c(CH3COOH) |
| B.c(H+)==c(CH3COO-)+c(OH一) |
| C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) |
| D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
有 ① Na2CO3溶液② CH3COONa溶液③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是 ()
| A.3种溶液pH的大小顺序是 ③>②>① |
B.若将 3种溶液稀释相同倍数,pH变化最大的是② 3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |