下列转化关系中,A—L均为中学化学中常见的物质,其中D为用途广泛的金属单质,B在常温常压下为无色液体,G为不溶于水但可溶于酸的白色固体,I为无色气体且能使湿润的红色石蕊试纸变蓝,L为无色气体,遇空气变为红棕色。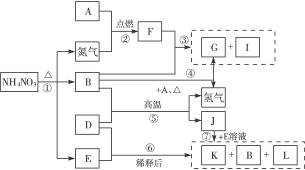
请完成下列问题:
(1)构成单质D的元素在元素周期表中处于第____________周期____________族。
(2)I物质的电子式为____________,F物质的化学式为____________;它们的晶体类型分别是:____________、____________。
(3)写出下列反应的化学方程式:
③___________________________________________;
⑤___________________________________________。