2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)
氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H = KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,身被还原为四价钒化合物;四价钒化合物
再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,则由S(s)生成3 molSO3(g)的△H = 。
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有(填序号)。
CO(g)+H2O(g),这是一个(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率(填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率(填序号)。
A.前者大B.后者大C.一样大D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。
①图示可知,分析HNO3与铁反应的规律是。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是(填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知:
(1)写出反应类型:①,④。
(2)写出反应的条件⑤,⑦。
(3)写出C的结构简式,其中含氧官能团是,B的结构简式。
(4)下列可检验阿司匹林样品中混有水杨酸的试剂是。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
(5)写出反应③的化学方程式。
(6)写出反应⑧的化学方程式。
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② |
|||
| ⑦ |
⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是,②元素的氧化物的电子式是,②与⑧形成的化合物中存在的化学键是,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是(用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是(用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
①写出反应a的化学方程式:。
②写出戊与丁反应的化学方程式:。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。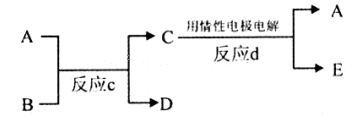
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为:。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为。
已知2A2(g)+B2(g) 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是(填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。