某高分子材料的结构为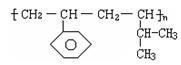 ,则其对应的单体的结构简式为:______________________,______________________。
,则其对应的单体的结构简式为:______________________,______________________。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH +Na2CO3 = 2CH3COONa+CO2↑+H2O依照该规律,请判断下列反应不能成立的是___________(填编号)。
+Na2CO3 = 2CH3COONa+CO2↑+H2O依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2H ClO ClO |
B.CO2+H2O +NaClO = NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa F.CH3COOH+NaCN = CH3COONa+HCN
NaHCO3+C6H5ONa F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是(填编号),其pH值为_______(填数值);pH最大的是(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规 律。下列转化都属于复分解反应:
律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得 苛性钠溶液
苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。请根据上述反应,总结出复分解反应发生的另一规律。
根据这结论,现将Na2S和AgI固体混合搅拌,则反应的离子方程式。
下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:F,H。
若反应①是在加热条件下进行,则A是;若反应①是在常温条件下进行,则A是。
(2)写出B与MnO2共热获得D的化学方程式 。
。
(3)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4mo1/L ,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KⅠ溶液,观察到的现象,沉淀能够发生转化的原因是。
元素A、B、C是元素周期表中短周期的三种元素,请根据表中信息回答下列问题。
| 元素 |
A |
B |
C |
| 性质结构信息 |
单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同。 |
单质是带有金属光泽的灰黑色固体,是信息技术的关键材料。 |
最高价氧化物的水化物 与其气态氢化物反应得到离子化合物D。 与其气态氢化物反应得到离子化合物D。 |
(1)写出B在元素周期表的位置__________。
(2)C的气态氢化物的电子式__________,检验D中阳离子的实验方法是______________。
(3)D的水溶液呈_________(填“酸性”、“碱性”或“中性”),其原因用离子方程式表示为________________________。
硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式:。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq)K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq)K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10—7 K2=4.7×10—11 |
K=1.75×10—5 |
下列说法正确的是。
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
| A.Ba(OH)2溶液 | B.BaCl2溶液 |
| C.NaOH溶液 | D.澄清的石灰水 |
(2)将加热后的溶液冷却到10℃,若溶液的pH________8.3(填“大于”“小于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。