将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请完成下列问题:
(1)NO的体积为___________L,NO2的体积为___________L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸物质的量浓度为___________ mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水___________g。
6.5g Zn在与足量盐酸反应时产生的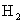 在标准状况下的体积是多少升?
在标准状况下的体积是多少升?
已知某主族金属元素X的原子核内质子数和中子数之比为1:1,含该金属阳离子0.192g的溶液恰好能将20mL0.4mol/L的Na2CO3溶液中的CO32-全部沉淀,推断X是什么元素及在周期表中的位置。
周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是A______、B_______、C________ (填元素符号)。
铜有两种天然同位素 Cu和
Cu和 Cu,参考铜的原子量(63.5)估算
Cu,参考铜的原子量(63.5)估算 Cu的百分含量约是
Cu的百分含量约是
| A.20% | B.25% | C.50% | D.66.7% E. 75% |
下图是超导化合物----钙钛矿晶体中最小重复单元(晶胞)的结构。请回答: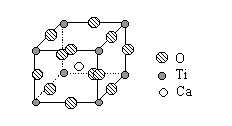
(1)该化合物的化学式为。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有个。
(3)设该化合物的式量为M,密度为ag/cm3,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为。