某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、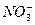 、
、 、
、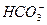 、Cl-等,取该溶液进行如下实验:
、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。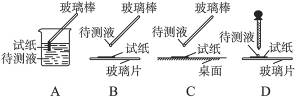
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是___________________。
(3)写出与②和③两个实验有关的离子方程式:
②____________________________________________,
③____________________________________________。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答: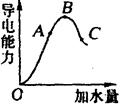
(1)“O”点导电能力为“0”的理由是
。
(2)A、B、C三点pH由大到小的顺序是__________________。
(3)A、B、C三点电离度最大的是_____________。
请用下图的装置设计一个实验,以测定SO2转化为SO3的转化率。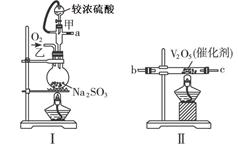
(1)这些装置的连接顺序(按气体从左到右的方向)是___________。(填各接口的编号)
(2)实验时甲仪器的作用与原理是____________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是________________________________。
(4)Ⅳ处观察到的现象是___________________________。
(5)在Ⅰ处用大火加热烧瓶时SO2的转化率会__________。(填“填大”“不变”或“减小”)
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为______________。
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素。A、C两元素可形成原子个数之比为2︰:1、1︰1型化合物。B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。F元素的最外层电子数是次外层电子数的0.75倍。请回答:
(1)D与F形成D2F的电子式为______________;A、C、D三种元素组成的化合物含有化学键的类型是________________;
(2)由E、F两种元素组成的化合物1 mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为___________ mol。
(3)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为_________________________________ 。
(4)工业上在高温的条件下,可 以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1 mol A2C和1 mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相同)。下列说法正确的是________________ 。
A.达到平衡所需要的时间:Ⅰ>Ⅱ B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
| A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
| C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 |
| D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 |
(2)NH4CuSO3中的金属阳离子的核外电子排布式为_______________。
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式_____。
(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。
(14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|||||||||||||||||
| B |
C |
D |
E |
F |
|||||||||||||
| G |
H |
I |
J |
K |
L |
||||||||||||
| M |
N |
||||||||||||||||
试回答下列问题:
(1)请写出元素N的基态原子电子排布式________________________________。
(2)元素B、G形成的单质熔点更高的是______________(填化学式),原因是____________________
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为_____________________。