某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
⑴氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) ▲ Ksp(ZnS)(选填“>”“<”或“=”)。
⑵物质A可使用下列物质中的 ▲ 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
⑶除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 ▲ 范围之间。
⑷物质B可直接用作氮肥,则B的化学式是 ▲ 。
已知:HCN的结构为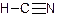 ,R—CN RCOOH,R—Cl+CN- R—CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,R—CN RCOOH,R—Cl+CN- R—CN+Cl-(R为烃基)。玉米芯、甘蔗渣等废物水解发酵后可制得糠醛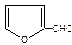 ,它是重要的化工原料,它在一定条件下可发生以下变化:
,它是重要的化工原料,它在一定条件下可发生以下变化:
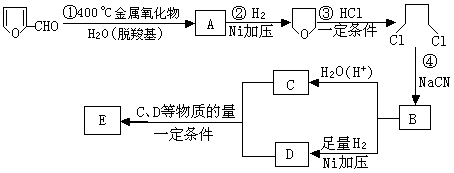
试回答下列问题:
(1)写出A、B、D的结构简式:A,B, D。
(2)写出下列化学方程式:③;
④。
(3)若E为环状化合物,则其结构简式。
(4)若E为高聚物,则其结构简式。
阅读下文,并回答(1)~(3)小题。
20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各五一节都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源 (2)在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重。最近研制出一种新材料聚乳酸:
(2)在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重。最近研制出一种新材料聚乳酸:
它能代替聚苯乙烯,它由乳酸聚合而成,能在乳酸菌的作用下,降解而消除对环境的污染。下列关于聚乳酸的说法正确的是
A.聚乳酸的单体是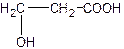
B.聚乳酸的单体自身分子间在一定条件下能够相互反应生成环状化合物
C.聚乳酸是一种羧酸
D.单体聚合成聚乳酸的方式与单体聚合成聚苯乙烯的方式相同
(3)1996年美国罗姆斯公司的G.L.Willingham等人研制出对环境安全的船舶防垢剂──“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如下式:
试回答下列问题: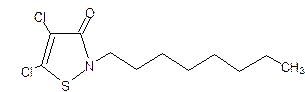
①“海洋9号”的化学式为________;
②“海洋9号”能在一定条件下与H2发生加成反应,写出“海洋9号”与足量氢气加成产物的结构简式;
③若“海洋9号”分子中的氢原子被一个氯原子取代,所得一氯取代物的种数为。
美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3微米的红外激光能切断B(CH3)3分子中的一个B—C键,使之与HBr发生取代反应:
B(CH3)3+HBr B(CH3)2Br+CH4,而利用9.6微米的红外激光却能切断两个B—C键,并与HBr发生二元取代反应。
B(CH3)2Br+CH4,而利用9.6微米的红外激光却能切断两个B—C键,并与HBr发生二元取代反应。
(1)试写出二元取代的代学方程式:
(2)现用5.6g B(CH3)3和9.72g HBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质的量之比为多少?
实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:
② 将空气通过灼热的活性铜粉制得较纯净的N2
③ 加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
(l)按途径 ① 制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为: ,最好要用上述仪器中的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
,最好要用上述仪器中的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
(2) ① 和 ② 两种途径常常被协同使用。这种方法与途径 ③ 相比优点是
(3)检查 E 装置气密性的方法是 。利用 E 装置还可以制取的气体有(写出三种)。
中学化学中几种常见物质的转化关系如下图所示(部分反应物、生成物及反应条件已略去):
已知:B、C、D为常见单质,其中C为气体,B、D为金属;F为常见的强酸;K常温下为气体,目能使品红溶液褪色;将 E 溶液滴入沸水可制得一种红褐色胶体; J 为红棕色固体。请回答下列问题:
 |
( l ) B 的化学式为 ;
写出 B 与 F 反应的化学方程式
( 2)实验中保存 G 溶液时要加入 目的是
( 3)为实现J一D的变化,若X是非金属单质,则X可能是 (写化学式); 若X是金属单质,请写出 J 一 D 反应的化学方程式