氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: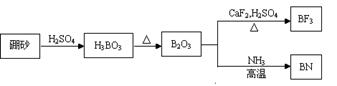
请回答下列问题:
1)由B2O3制备BF3、BN的化学方程式依次是 、 ;
2)基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
3)在BF3分子中,F-B-F的键角是 ,B原子的杂化轨道类型为 ,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为 ;
4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g/cm3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
抗击“非典”期间,过氧乙酸(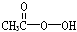 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4+□H2O2+□H+═□Mn2++□O2十□H2O
② H2O2+2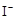 +2H+ ═I2+2H2O
+2H+ ═I2+2H2O
④ I2+2S2O32-═S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO-4+□H2O2+□H+ ═□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·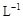 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·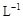 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中只有C为金属元素,A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A,B,C,D。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,非极性分子有;其结构中存在非极性键的分子晶体有;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种:、。
把淀粉溶液溶于沸水中,制成淀粉胶体。
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是,该操作的名称是。
(8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(不需配平)_________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:
________________________________________________________________________。
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl•xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、 Al2O3、HCl和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。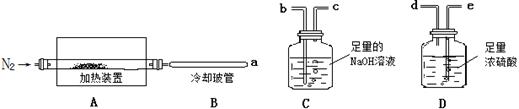
(1)Mg2Al(OH)6Cl•xH2O热分解的化学方程式为。
(2)若只通过测定装置C、D的增重来确定 ,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
(3)加热前先通过N2排尽装置中的空气,反应完成后,再持续通入N2的作用是。
(4)完全分解后测得C增重3.65g、D增重9.90g,则 =.
=.