下列离子方程式改写成化学方程式正确的是( )
A.Mg2++2OH- Mg(OH)2↓ Mg(OH)2↓MgSO4+Ba(OH)2  Mg(OH)2↓+BaSO4↓ Mg(OH)2↓+BaSO4↓ |
B.Fe+Cu2+ Fe2++Cu Fe2++CuFe+Cu(OH)2  Fe(OH)2+Cu Fe(OH)2+Cu |
C.Ag++Cl- AgCl↓ AgCl↓AgNO3+HCl  AgCl↓+HNO3 AgCl↓+HNO3 |
D.CO2+2OH- CO CO +H2O +H2O |
CO2+Ca(OH)2 CaCO3↓+H2O
CaCO3↓+H2O
下列关于物质用途的叙述中正确的是
| A.单质硅可用于制造光纤和太阳能电池 |
| B.在常温下可用铝制容器贮藏运输浓硫酸 |
| C.纯碱可作治疗胃酸过多的一种药剂 |
| D.SO2可用于漂白一切有色物质 |
3He可以作为核聚变材料。下列关于3He的叙述正确的是
| A.3He和3H互为同位素 | B.3He原子核内质子数为3 |
| C.3He原子核内中子数为1 | D.3He原子易失去两个电子 |
下列关于化学与生产、生活的认识错误的是
| A.CO2、SO2、N2等均是造成温室效应的气体 |
| B.节能减排符合低碳经济的要求 |
| C.使用清洁能源是防止酸雨发生的重要措施之一 |
| D.大量焚烧田间秸秆会污染空气 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH¯)>c(N3¯)>c(H+) |
| D.0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
可逆反应N2 (g)+3H2(g) 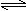 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
| A |
B |
C |
D |
|
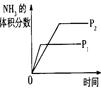
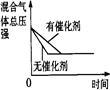
| 研究 目的 |
压强对反应的影响 (p2>p1) |
温度对反应的影响 |
平衡体系增加N2的 浓度对反应的影响 |
催化剂对反应的影响 |
| 图 |
 |
 |
 |
 |