(本小题15分) A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
(1)写出四种元素元素符号:A、____B、____C、____D、____。
(2) F的电子式:_________________。
(3)写出E、F混合后加水的化学方程式:_________________________________。
(4)写出GJ的化学方程式:_________________________________。
(5)写出C单质与H水溶液反应的离子方程式:_____________________________。
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式:Cu + 2FeCl3 ═ CuCl2 + 2FeCl2
(1)请在上式中标出电子转移的方向和数目。
(2)上述反应中的氧化剂是:。
(3)写出FeCl3的电离方程式:。
(4)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是(填序号)
| A.氯气 | B.铁 | C.双氧水 | D.稀硫酸 |
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g)△H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为kJ/mol。
2NH3(g)△H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为kJ/mol。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
a |
945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l)ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式:。
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。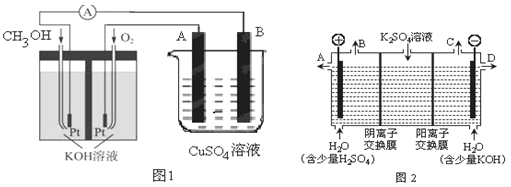
①写出燃料电池正极的电极反应式。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是极(填“A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为L。
(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为。
②从出口D导出的溶液是(填化学式)。
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,反应中NH3的浓度变化如下图:
2NH3(g)△H<0,反应中NH3的浓度变化如下图: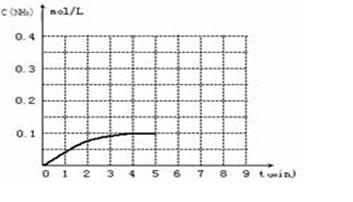
(1)根据上图,4min~5min之间,反应处于_________状态;(填“平衡”或“非平衡”)。
计算0~4min内,平均反应速率υ(NH3)=。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,反应达到新平衡后,则NH3的物质的量浓度不可能为。
| A.0.2mol·L-1 | B.0.12mol·L-1 | C.0.10mol·L-1 | D.0.08mol·L-1 |
(3)反应达到平衡后,第5分钟末,保持其它条件不变,把容器的体积缩小为原来的一半,则平衡________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”)。
(4)在第5分钟末,将容器体积缩小为原来的一半后,若在第8分钟末达到新的平衡时(此时NH3的浓度约为0.25mol·L-1)。请在上图中画出第5分钟末到平衡时NH3浓度的变化曲线。
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)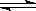 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1)K的表达式为:;
(2)该反应的正反应为反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:
A.容器中压强不再变化
B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化
D.c(CO2) •c(H2)= c(CO)•c(H2O)
(4)当温度为850℃,在2L密闭容器中通入1.0 mol CO2和1.0 mol H2,则平衡后,CO2的转化率为。
(5)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO2 |
H2 |
CO |
H2O |
| 2.0 mol |
2.0 mol |
0.5 mol |
8.5 mol |
 此时上述的反应中正、逆反应速率的关系式是(填代号)。
此时上述的反应中正、逆反应速率的关系式是(填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为。
(2)B中Sn极的电极反应式为。Sn极附近溶液的pH值(填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是,该电极电极反应式为,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为。