1.92 g Cu跟适量的浓硝酸反应,Cu全部反应后,共收集到气体1.12 L(标准状况),反应消耗的HNO3的物质的量可能是( )
| A.0.12 mol | B.0.11 mol |
| C.0.09 mol | D.0.08 mol |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶质为NaA、HA,则一定存在: c(A-)> c(Na+)> c(H+)> c(OH-)
B.溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在: c(Na+)> c(OH-)> c(A-)> c(H+)
D.若溶液中c(A-)=c(Na+),则溶液一定呈中性
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:Ag Cl(s)
Cl(s)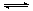 Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是: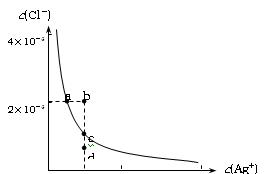
| A.加入NaCl可以使溶液由a点变到b点 |
| B.b点和d点均无AgCl沉淀生成 |
| C.a点对应的Ksp大于c点对应的Ksp |
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀。其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq)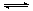 Ag2S(s)+2Cl-(aq) 。 Ag2S(s)+2Cl-(aq) 。 |
下列叙述正确的是
| A.c(NH)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol·L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO)+c(OH-) |
在下图中的8个装置中, 属于原电池的是
属于原电池的是
| A.①④⑤ | B.③⑥⑧ | C.④⑥⑦ | D.⑥⑦⑧ |
把A、B、C、D四块金属片浸入稀硫酸中, 分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A