将过量的铁粉投入一定量的热浓硫酸中(含2 mol H2SO4),按照中学教材上H2SO4与铁反应的有关知识填空:
(1)若反应结束后,有1.5 mol铁被溶解,产生的气体是_______,质量为_______g。
(2)反应停止后,有W g铁粉溶解,产生的SO2在标准状况下所占有的体积是_______L。
由于氢氧化亚铁在空气中能迅速被氧气氧化成氢氧化铁,因此要观察到氢氧化亚铁的颜色往往较为困难。某研究性学习小组的同学经过讨论后,设计出了三套能较长时间观察Fe(OH)2沉淀颜色的装置,如图。

1.根据装置①,要想达到实验目的,应先挤胶头滴管_______(填“A”或“B”)
2.利用装置②,所用试剂为NaOH溶液、铁屑、稀硫酸,
(1)试管A中加入的试剂是_________试管B中加入的试剂是_______
(2)为了制得Fe(OH)2白色沉淀,现准备进行如下操作:先向试管A和B中加入试剂,然后_____(“打开”或“关闭”)止水夹,塞紧塞子,接下来的实验步骤是____________________
3.装置③时利用电解原理来达到实验目的的。
(1)电极材料是铁棒(Fe)和碳棒(C),A极应为_______(填材料的元素符号)
(2)电解质溶液可选用__________(填选项序号)
A.NaCl溶液 B.CuSO4溶液 C.Na2SO4溶液 D.NaOH溶液
(3)该实验准备选用一种有机物来起到隔绝空气的作用,该有机物可以是__________
工业上常用铁质容器盛装冷浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L 酸性KMnO4溶液、0.10 mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有气体。
【实验探究】
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液中 |
||
| 步骤②: |
含有Fe3+ |
||
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
含有两种或以上气体 |

【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行,并说明原因:。
(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如下图(图中夹持仪器省略)。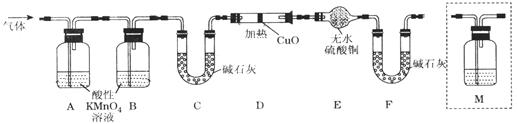
①Q产生的原因是(用化学方程式表示)。
②为确认Q的存在,则M中盛放的试剂为,并将装置M添加于(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图中D、E、F组合的作用是。
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH溶液.并置于热水浴中;③的试管里盛有15mL 8%NaOH溶液.并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是。反应完毕经冷却后,②的试管中有大量晶体析出。图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是_____(填写实验操作名称)。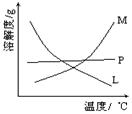
(3)本实验中制取次氯酸钠的离子方程式是:。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为___色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为___色 |
_________________________________________ |
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。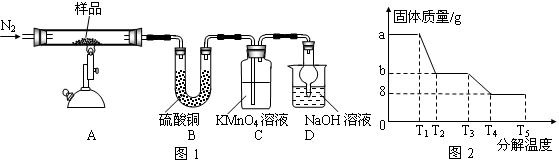
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式。
(5)装置D球形干燥管的作用。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=。
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)酸性条件下高锰酸钾溶液分解的离子方程式 。
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
______MnO4—+______C2O42—+______H+=______Mn2++______CO2↑+____________
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) |
高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 |
1min |
| 褪色后再滴入第2滴 |
15s |
| 褪色后再滴入第3滴 |
3s |
| 褪色后再滴入第4滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度。他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
①高锰酸钾溶液应装在(填下图中的仪器编号)。
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是。
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是。
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为。