工业上常用铁质容器盛装冷浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.10 mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有 气体。
【实验探究】
| |
实验操作 |
预期现象 |
结 论 |
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液中 |
|
|
| 步骤②: |
|
含有Fe3+ |
|
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种或以上气体 |

【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行,并说明原因: 。
(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如下图(图中夹持仪器省略)。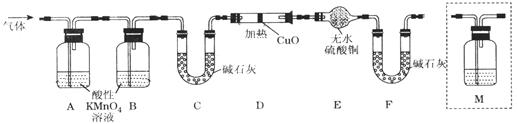
①Q产生的原因是 (用化学方程式表示)。
②为确认Q的存在,则M中盛放的试剂为 ,并将装置M添加于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图中D、E、F组合的作用是 。
某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应的离子方程式为_________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的离子方程式为__________________。
(3)若A为第二周期的单质,B为第二周期某元素最高价氧化物的水化物,C、D均为气体,则该反应的化学方程式为____________________________________。
(4)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,则A是______或_______,B为_____________(填化学式,下同)。
(5)若C、D均是能使澄清石灰水变浑浊的气体,则A与B的组合为_____________。
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。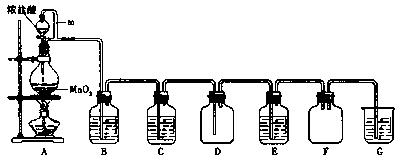
(1)写出圆底烧瓶中反应的化学方程式。
(2)A中m管的作用是;装置F的作用是。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是,C中应盛放的试剂是 。
。
(4)E中若装有FeCl2溶液,反应的离子方程式为;E中若装有淀粉碘化钾溶液,能观察到的实验现象是。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热 b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是;实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是。
右图为实验室某浓盐酸试剂瓶上的标签,试 根据有关数据回答下列问题:
根据有关数据回答下列问题: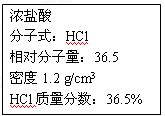
(1)该浓盐酸中HCl的物质的量浓度为mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是。
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。
(5)在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位)
某同学在学校实验室里发现两瓶失去标签的溶液(标记为A、B),经询问实验员得知是稀硫酸和小苏打(NaHCO3)溶液。为了区分它们,该同学进行了如下实验,请你协助他完成相关问题的解答:
(1)取少量A、B两溶液,分别加入适量Na2CO3,观察到A中有大量气泡,B中没有明显变化现象。A溶液中发生反应的化学方程式是____________________。
(2)取少量A、B两溶液,分别加入几滴酚酞试液,A仍为无色,B为浅红色,分别再逐滴加入过量的NaOH溶液,A中的现象是___________________________,其离子方程式是_________________________________;B中的现象是_________________________,其离子方程式是___________________________________________________________。
某课外小组对一些金属单质和化合物的性质进行研究。下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
|
| Ⅰ |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。充分反应后,过滤。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| Ⅱ |
滤液中加入少量的NaOH溶液。 |
有白色沉淀产生。 |
| Ⅲ |
将所得红色固体用蒸馏水洗涤后,加热烘干。 |
少量红色固体变黑 |
Ⅰ反应的离子方程式 ,
Ⅱ反应的离子方程式 ,
Ⅲ反应的化学方程式 。