有含1 mol CO、1 mol NH3和1 mol NO的气体混合物,现拟通过下述操作,从其中分离出纯净干燥的CO:①通过浓烧碱溶液;②通过浓硫酸;③加入0.5 mol O2。正确的操作顺序是(提示:2NO2+2NaOH====NaNO3+NaNO2+H2O)( )
| A.②③① | B.③①② | C.②①③ | D.③②① |
下列四种溶液中:①pH值为0的盐酸;②0.1mol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为
| A.0︰1︰12︰11 | B.14︰13︰12︰11 |
| C.14︰13︰2︰3 | D.1︰10︰100︰1000 |
将烧碱溶液和盐酸依次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是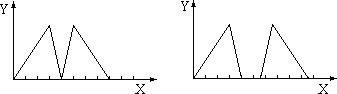
| A.三溴化铝溶液 | B.偏铝酸钠溶液 | C.明矾溶液 | D.硝酸铝溶液 |
下列反应的离子方程式书写正确的是
| A.将溶质物质的量之比为2∶7的三氯化铝溶液和氢氧化钡溶液混合 2Al3+ + 7OH- = Al(OH)3 ↓ + AlO2- + 2H2O |
| B.将溶质物质的量之比为4∶3的 硫酸氢钠和氢氧化钡溶液两溶液混合: 4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O |
| C.用石墨电极电解碘化镁溶液 2 I- - 2 e- =" I" 2 |
| D.将16.8g铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO) |
6Fe + 20 H++ 5NO3- = 3Fe2+ + 3Fe3+ + 5NO↑ +10H2O
下列各组物质的相互关系正确的是
| A.同位素:1H+、2H-、2H2、2H 、3H |
| B.同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯 |
| C.同素异形体:C20、C60、C金刚石、C石墨 |
| D.同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 |
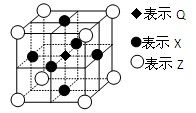
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列。
回答下列问题:
(1)Z的核外电子排布式是。
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为。
(3)QR2分子中,Q原子采取杂化,写出与QR2互为等电子体的一种分子的化学式:。
(4)分子式为Q2G6R的物质有两种,其中一种易溶于水,原因是;T的氯化物的熔点比Y的氯化物的熔点高,原因是。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如图所示。晶体中距每个X原子周围距离最近的Q原子有个。